|
第Ⅰ卷(选择题,共50分。)
一、选择题(每小题只有一个选项符合题意。每小题3分,共30分。)
1.20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段。下列各项中不属于绿色化学的是( )。
(A)处理废弃物 (B)治理污染点
(C)减少有毒物 (D)杜绝污染源
2.下列说法中正确的是( )。
(A)难失电子的原子,获得电子的能力一定强
(B)易得电子的原子所形成的简单阴离子,其还原性一定强
(C)分子中键能越大,键长越长、则分子越稳定
(D)电子层结构相同的不同离子,核电荷数越多,半径越小
3.物质的量浓度相同的下列等体积溶液中,吸收 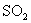 气体的量最多的是( )。 气体的量最多的是( )。
(A) 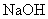 (B) (B) 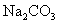 (C) (C) 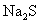 (D) (D) 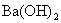
4.将盛有某种金属卤化物和浓硫酸的烧瓶加热后,可制取无色卤化氢气体,则该金属卤化物是( )。
(A)氟化物 (B)氯化物 (C)溴化物 (D)碘化物
5.下列四种气体(括号内是混有的少量杂质),可用下图所示仪器装置进行净化和干燥的气体是( )。
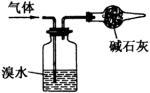
(A) 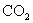 ( ( 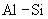 ) (B) ) (B) 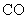 ( ( 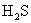 ) )
(C) 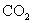 ( ( 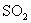 ) (D) ) (D) 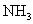 ( ( 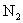 ) )
6.造纸工业常用 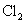 漂白纸浆。漂白后的纸浆要用 漂白纸浆。漂白后的纸浆要用  除去残留的 除去残留的 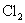 ,其反应为: ,其反应为:
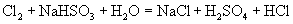 ,在这个反应中,氧化产物与还原产物的物质的量之比是( )。 ,在这个反应中,氧化产物与还原产物的物质的量之比是( )。
(A)1:1 (B)2:1 (C)1:2 (D)2:3
7.下列材料中,最不宜用于制造储存浓硫酸容器的是( )。
(A)铁 (B)铝 (C)铜 (D)陶瓷
8.下列各组物质在一定条件下能发生反应的是( )。
① 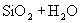 ② ② 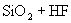 ③ ③ 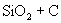
④ 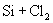 ⑤ ⑤ 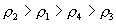 ⑥ ⑥ 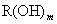
(A)②③④⑤⑥ (B)只有③④⑤
(C)只有④⑤⑥ (D)只有①②③
9.下列各组稀溶液不用其他试剂和试纸,就可以将它们区别开的是( )。
(A)硝酸钾 硫酸铜 硫酸氢钠 氯化钡
(B)硫酸 硫酸铝 氯化钠 硝酸钠
(C)盐酸 硫酸钠 硝酸钠 氢氧化钠
(D)硫酸镁 碳酸钠 氢氧化钠 氯化钾
10.质量分数不同的2种硫酸溶液,以相同质量混合时,所得混合溶液密度为 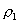 ;以相同体积混合时,所得混合溶液密度为 ;以相同体积混合时,所得混合溶液密度为 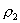 。2种浓度不同的乙醇溶液,以相同质量混合时,所得混合溶液密度为 。2种浓度不同的乙醇溶液,以相同质量混合时,所得混合溶液密度为 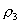 ;以相同体积混合时,所得混合溶液密度为 ;以相同体积混合时,所得混合溶液密度为 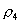 。则 。则 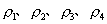 之间大小关系正确的是( )。 之间大小关系正确的是( )。
(A) 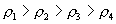 (B) (B) 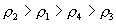
(C) 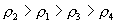 (D) (D) 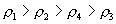
二、选择题(每小题有一个或两个选项符合题意。每小题4分,共20分。)
11.下列各组离子在pH=1的溶液中,因发生氧化还原反应而不能大量共存的是( )。
(A) 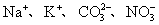 (B) (B) 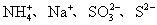
(C) 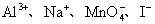 (D) (D) 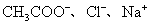
12.硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol/L 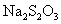 溶液恰好把标准状况下的224mL 溶液恰好把标准状况下的224mL 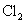 完全转化为 完全转化为 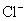 离子,则 离子,则 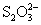 将转化成( )。 将转化成( )。
(A) 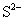 (B) (B) 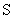 (C) (C) 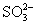 (D) (D) 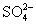
13.对于复分解反应:X+Y=Z+W,下列叙述中正确的是( )。
(A)若Z是强酸,则X和Y必有一种是酸
(B)若Y是强碱,X是盐,则Z或W必有一种是弱碱
(C)若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
(D)若W是弱碱,Z是盐,则X和Y必有一种是强碱
14.下列反应的离子方程式中,错误的是( )。
(A)将 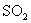 通入 通入 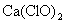 溶液: 溶液:
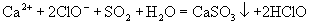
(B)用氨水吸收少量的二氧化硫气体:
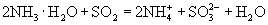
(C) 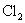 通入 通入 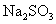 溶液中: 溶液中:
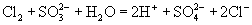
(D)硫酸氢钠溶液与氢氧化钡溶液以等物质的量混合:
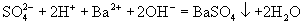
15.已知:A、B、C、D、E是核电荷数依次增大的五种短周期元素;原子半径按D、E、B、C、A的顺序依次减小;B和E同主族。下列推断中不正确的是( )。
(A)A、B、E一定在不同周期
(B)C的最高价氧化物对应的水化物可能显碱性
(C)A、D可能位于同一主族
(D)C和D的单质可能化合形成离子化合物
第Ⅱ卷(非选择题,共50分。)
三、(本题包括2小题,共12分。)
16.(4分)回答下列问题:
(1)在进行沉淀反应的实验中,如何认定沉淀已经完全?
(2)中学化学实验中,在过滤器上洗涤沉淀的操作是 。
17.(8分)有一小块 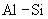 合金质量为m g,请从下图中选用适当的实验装置,设计一个简单合理的实验,测定合金中Al的质量分数。可供选用的试剂还有:浓 合金质量为m g,请从下图中选用适当的实验装置,设计一个简单合理的实验,测定合金中Al的质量分数。可供选用的试剂还有:浓 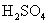 、浓 、浓 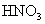 、6mol/L的 、6mol/L的 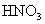 、6mol/L的 、6mol/L的 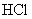 、6mol/L的 、6mol/L的 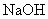 溶液。 溶液。
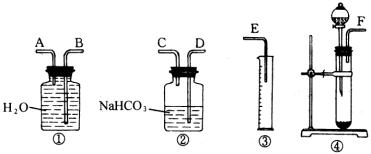
请填写下列空白:
(1)写出实验中合金参与反应的化学方程式: 。
(2)若气体流向从左到右,则所选装置的玻璃管接口顺序为 (填字母代号)。
(3)简述选用或不选用装置②的理由: 。
(4)按上述(2)的方式连接仪器,还可进行下列哪些定量测定: 。
A.用一定质量的纯锌粒测定Zn的相对原子质量
B.用  与盐酸反应,测定盐酸的浓度 与盐酸反应,测定盐酸的浓度
C.测定 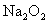 和 和 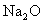 混合物中 混合物中 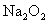 的质量分数 的质量分数
D.用加热分解的方法测定 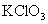 的纯度 的纯度
四、(本题包括4小题,共25分。)
18.(5分)在氮化硅中添加氧化铝,用氧原子替代一部分氮,用铝原子替代一部分硅,通过常压烧结即成新一代无机非金属材料,叫氧氮硅铝,即赛伦(Sialon),化学通式为 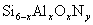 ( ( 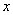 为2~4)。试回答: 为2~4)。试回答:
(1)赛伦有 等特性(至少写3种)。
(2)化学通式里的y值为 (用含 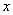 的表达式或某一具体数值表示)。 的表达式或某一具体数值表示)。
19.(7分)(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
① 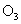 : 。② : 。② 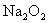 : 。③ : 。③ 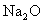 : 。 : 。
(2)指出氧在下列各物质中的化合价: 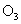 ; ; 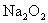 ; ; 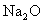 。 。
(3) 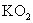 能吸收 能吸收 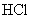 生成 生成 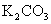 和 和 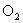 ,故可用作特殊情况下的氧气源,试写出该反应的化学方程式: 。 ,故可用作特殊情况下的氧气源,试写出该反应的化学方程式: 。
(4)人体内 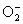 离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: 离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:
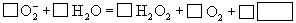
20.(7分)A、B、C、D、E、F为原子序数依次增大的同周期主族元素。已知:A、C、F三原子的最外层共有10个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均能生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:B ,D ,E 。
(2)五种元素中,原子半径最大的是 ,常温下能与水剧烈反应的单质的元素是 ,气态氢化物最稳定的是 (用A、B、C、D、E、F回答)。
(3)A、C两种元素最高价氧化物对应的水化物反应的离子方程式是 。
21.(6分)向100mL 3mol/L硫酸铝铵[ 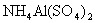 ]溶液中逐滴加入1mol/L ]溶液中逐滴加入1mol/L 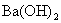 溶液。 溶液。
(1)写出当刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示): 。
(2)随着 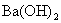 溶液体积V的变化,沉淀总物质的量n的变化如下图所示。写出B点和C点所对应的 溶液体积V的变化,沉淀总物质的量n的变化如下图所示。写出B点和C点所对应的 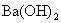 溶液的体积:B ,C 。 溶液的体积:B ,C 。
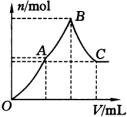
五、(本题包括2小题,共13分。)
22.(6分)第ⅠV主族元素R,在它的化合物  中,其质量分数为0.778,在它的另一种化合物 中,其质量分数为0.778,在它的另一种化合物 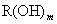 中,其质量分数为0.636。 中,其质量分数为0.636。
(1)试求n和m的值:  , , 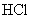 。 。
(2)试求R的相对原子质量: 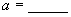 。 。
23.(7分)用20mL 18.4mol/L浓 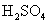 和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,测得 和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,测得 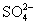 离子浓度为3.18mol/L。试求溶液中 离子浓度为3.18mol/L。试求溶液中 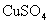 的物质的量浓度。 的物质的量浓度。
答案:
1.C 2.D 3.C 4.B 5.B 6.C 7.C 8.A 9.A 10.B
11.BC 12.D 13.C 14.AD 15.B
16.(1)在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产生沉淀,说明沉淀完全。(2)向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次。
17.(1) 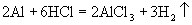 。 (2)F→A→B→E。 。 (2)F→A→B→E。
(3)不选用;排水法水可以把 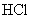 溶解掉,若选用②,生成的 溶解掉,若选用②,生成的 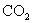 反而使测得的 反而使测得的 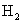 的体积增大。 的体积增大。
(4)A、C。
18.(1)耐高温、高强度、超硬度、耐磨损、抗腐蚀、热稳定性好。
(2) 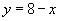 。 。
19.(1)① 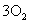  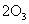 ② ② 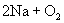 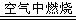 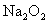
③ 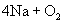  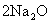
(2)0;-1;-2。
(3) 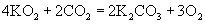 。 。
(4)2、2、1、1、2 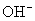 。 。
20.(1)Mg;Si;P。 (2)A;A;F。
(3) 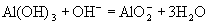 。 。
21.(1) 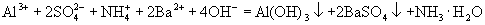
(2)600mL;750mL。
22.(1)2;4。 (2)119。
23.0.5mol/L
|