|
氧族元素 环境保护
[复习目标导航]
1、理解氧族元素的性质变化规律;掌握氧族元素的原子结构与其单质和化合物性质递变的关系。
2.掌握臭氧的物理性质、化学性质及臭氧层的保护;掌握同素异形体的概念.
3.掌握二氧化硫的性质及制备的化学反应。了解二氧化硫的用途。
4.掌握硫酸的性质,尤其应掌握浓硫酸的特性。掌握硫酸根离子的检验方法。
5.了解硫酸和硫酸盐的重要用途。
6.了解环境保护的概念;了解防止环环境污染的初步知识。
[知识构架链接]
1、硫化氢的的理性质:是一种具有臭鸡蛋气味、无色、有剧毒的气体,能溶于水,常温常压1体积水能溶解2.6体积的硫化氢。
2、硫化氢的化学性质
热不稳定性 H2S====H2 S
可燃性 2H2S+3O2===2H2O 2SO2 (完全燃烧)(火焰淡蓝色)
2H2S+O2===2H2O 2S (不完全燃烧)
还原性 SO2+2H2S=2H2O+3S
3、氢硫酸
硫化氢的水溶液是一种弱酸,叫氢硫酸,具有酸的通性和还原性。
4、二氧化硫的物理性质:二氧化硫是一种无色有刺激性气味有毒的气体,易溶于水,常温常压1体积水可溶解40体积的二氧化硫;三氧化硫是一种没有颜色易挥发的晶体,熔沸点低。
5、二氧化硫的化学性质:是一种酸性氧化物,与水直接化合生成亚硫酸,是亚硫酸的酸酐,二氧化硫具有漂白作用,可以使品红溶液腿色,但漂白不稳定。
SO2+H2O ==== H2SO3 (这是一个可逆反应,H2SO3是一种弱酸,不稳定,容易分解成水和二氧化硫。)
[重点难点提示]
重点:
氧族元素性质递变规律及其与原子结构的关系.
二氧化硫的性质.
浓硫酸的强氧化性和硫酸根离子的检验.
第一节 氧族元素
[复习辅导]
知识点一:氧族元素
1、氧族元素的名称和符号
氧(O) 硫(S) 硒(Se) 碲(Te) 钋(Po)
2、氧族元素的相似性
最外层者有6个电子,均能得到2个电子而达到稳定结构;
在气态氢化物中均显-2价,化学式为H2R;
在最高价氧化物中均显 6价;化学式为RO3;
最高价氧化物对应的水化物化学式为H2RO4;
3、氧族元素的递变性:随着核电荷数的增加,从氧到钋性质呈规律性变化;
单质熔沸点升高,密度增大,氧化性减弱;
气态氢化物稳定性减弱,还原性增强;
最高价氧化物对应的水化物酸性减弱;
原子半径依次增大,非金属性减弱,金属性增强;
知识点二:同素异形体
由同种元素形成的性质不同的几种单质。关键点:同一元素;单质;可相互转化。如H2和D2就不能称为同素异形体。
知识点三:臭氧
物理性质:有点腥气味淡蓝色有特殊气味的气体,密度比氧气大,比氧气易溶于水;液体呈深蓝色,固体中紫黑色。它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝(如何检验臭氧),反应中有氧气产生,这个反应的化学方程式是: ,这个反应的氧化产物是 ,还原产物是 。
化学性质:
不稳定性:常温分解
具有强氧化性:
用于:
制取:
用途:
知识点四:过氧化氢
可由过氧化钠制取,过氧离子实际是一种酸根,则反应是 反应类型;方程式为:
俗名: 是一种 色, 的液体,一般含量 ,呈弱酸性(联系过氧化钠)。
用于 。
知识点五:硫化氢
硫化氢的的理性质
H2S是一种具有臭鸡蛋气味、无色、有剧毒的气体,能溶于水,常温常压1体积水能溶解2.6体积的硫化氢。
硫化氢的化学性质
热不稳定性 H2S====H2 S
可燃性 2H2S+3O2===2H2O 2SO2 (完全燃烧)(火焰淡蓝色)
2H2S+O2===2H2O 2S (不完全燃烧)
还原性 SO2+2H2S=2H2O+3S
水溶液是氢硫酸,具有弱酸性:具有酸的通性和还原性。
与氧气反应的分析、判断、计算。
[互动交流解疑]
问题一:[生] 氧族元素的单质为什么没有同周期的卤素活泼?
[师] 同周期的氧族元素与卤素相比较,在所形成的单质中,它们又都是双原子分子,分子结构相似;氧族元素原子的原子核少了1个核电荷,最外层少了1个电子,原子核对最外层电子的作用力减弱。因此,单质没有卤素活泼。
问题二:[生] 为什么臭氧要比氧活泼?
[师] 臭氧分子在常温下易分解为氧分子和1个氧原子,氧原子由于没有达到稳定状态,易与其它原子结合,因而使臭氧表现出相当的活泼性。
[案例探究分析]
[例题1] 在标准状况下,750 mL含O3的O2,其中的O3若完全分解,其体积变为780 mL(标准状况),若将该含有O3的O2 1 L,通入适量的KI溶液中发生如下反应:2KI+O3+H2O====2KOH+I2+O2↑,则析出I2的质量为( )
A.0.68 g B.0.81 g C.0.91 g D.0.21 g
【解析】此题中,要求碘的质量必须求出臭氧的量。臭氧分解为氧气时,2摩变为3摩,物质的量增大1摩;或者说物质的量每增加1摩,则必有2摩臭氧反应;另题中所给的体积不有个数值,特别注意它们的转化。
则增加的体积为:(780-750)。臭氧的体积为:(780-750)×2(780-750)×2。1L中臭氧的体积为(780-750)×2÷750×1000÷22400。臭氧的物质的量为:(780-750)×2÷750×1000÷22400。碘的质量为:(780-750)×2÷750×1000÷22400×127×2。
【答案】C。
[例题2] 下列反应适用于实验室制备氧气的是
①高锰酸钾热分解 2KMnO4 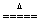 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑
②硝酸铵热分解 2NH4NO3 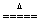 4H2O+2N2↑+O2↑ 4H2O+2N2↑+O2↑
③过氧化氢催化分解2H2O2 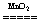 2H2O+O2↑ 2H2O+O2↑
④二氧化氮热分解2NO2 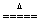 2NO+O2 2NO+O2
A.只有① B.①和② C.①和③ D.①③④
【解析】反应中有氧气产生和能用于制取氧气不是同一回事,能产生氧气反应才能用于制氧气,但它必须达到:易操作且适合于实验室内仪器的反应;制得的气体易于纯化。
【答案】 C。
[例题3] 针对以下A~D四个涉及H2O2的反应(未配平),填写空白
A.Na2O2+HCl——H2O2+NaCl B.Ag2O+H2O2——Ag O2+H2O
C.H2O2 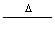 H2O+O2 H2O+O2
D.H2O2+Cr2(SO4)3+KOH——K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)H2O2体现弱酸性的反应是(填代号) ,其理由为 。
【解析】表现氧化性则其所含元素的化合价降低;既表现氧化性又表现还原性则其所含元素的化合价同时升高和降低;体现弱酸性则其能与酸反应或由酸制得。
【答案】(1)D;(2)C;(3)A 。
[例题4] 在化合物X2Y和YZ2中,Y的质量分数分别约为40%和50%,则在化合物X2YZ3中,Y的质量分数约为
A.20% B.25% C.30% D.35%
【解析】本题可用相对式量假设法计算。根据第一式子中的含量,假设Y的式量为40,则X的式量为30;由第二式子可知Z为20,则可知答案为B。本题也可用其它假设法。
【答案】B。
[例题5]氧、硫、硒、碲等元素,随着核电荷数的增大,其原子结构和性质呈现出规律性的变化。下列变化规律中,错误的是
A. 原子半径逐渐减小 B. 电子层数逐渐增多
C. 单质的熔点逐渐升高 D. 固态单质的密度逐渐增大
【解析】根据元素同主族元素的性质变化规律,氧族 元素的原子半径增大,电子层数增多,单质的熔点升高,密度增大。
【答案】A。
[例题6]根据氧族元素性质的变化规律,下列硒元素性质的判断中,错误的是
A. 硒能和氧反应生成SeO2,其水溶液呈酸性
B. 硒在常温下呈固态 C. 硒酸的酸性必然弱于碲酸
D. 硒化氢(H2Se)具有强还原性
【解析】 本题可用硫来推导:二氧化硫的水溶液呈酸性,因此二氧化硒的水溶液虽酸性弱点,但还是酸性溶液;硫在常温下呈固态,硒一定是固态;硒酸的酸性应强于碲酸;硫化氢的还原性较强则硒化氢的还原性更强。
【答案】C。
[自主达标检测]
一、选择题
1.随着核电荷数的增加,氧族元素的性质变化规律中,正确的是( )
A.单质的熔沸点依次升高 B.单质的密度逐渐增大
C.单质都是非金属,故都不能导电 D.它们的离子半径比相应原子半径小
2.下列气态氢化物中,最不稳定的是( )
A.H2O B.H2S C.H2Se D.H2Te
3.下列物质中,酸性最强的是( )
A.H2TeO4 B.H2TeO3 C.H2SO4 D.H2SO3
4.下列关于氧族元素(除钋外)的说法中正确的是( )
A.它们的最高价均为 6价
B.它们都能跟氢气直接化合生成气态氢化物
C.它们都能形成二氧化物和三氧化物
D.它们跟大多数金属都能直接化合
5.硫的非金属性比氧弱,但从以下的事实不能做出判断的是( )
A.硫化氢不如水稳定
B.硫跟氢气反应需要加热,而氧气跟氢气反应只需点燃
C.硫化氢的水溶液露置在空气中变浑浊
D.硫是固体,氧气在常温下是气体
6.下列叙述中错误的是( )
A.实验室可用浓H2SO4跟金属硒化物反应制取H2Se
B.H2SeO3中的Se,既具有氧化性,又具有还原性
C.硒酸钠的化学式为Na2SeO4
D.碲跟氢气化合比碘跟氢气化合更困难
7.钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能具有的性质是
A.钋是能导电的固体 B.钋的氧化物的水化物至少有两种
C.钋与氢气不能直接化合 D.钋的氢化物很稳定
8.H2S通入H2SeO3,溶液中所得氧化产物是( )
A.S B.Se C.S和Se D.不能反应,无氧化产物
9.能使溴水、酸性KMnO4溶液褪色的一组物质是( )
A.CO、H2、SO2、H2S B.H2S、SO2、H2Se、SeO2
C.CO、SO3、HCl、H2Se D.H2Se、SeO2、H2、HI
二、填空题
  11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染会破坏臭氧层,如超音速飞机排放物中的氮氧化 物(NO和NO2),它们和O3及O发生如下反应:O3 NO NO2 O2,O NO2 NO O2,这两个反应反复循环,其总反应式为 ,由 此可见氮氧化物在破坏臭氧层的过程中起了 的作用. 11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染会破坏臭氧层,如超音速飞机排放物中的氮氧化 物(NO和NO2),它们和O3及O发生如下反应:O3 NO NO2 O2,O NO2 NO O2,这两个反应反复循环,其总反应式为 ,由 此可见氮氧化物在破坏臭氧层的过程中起了 的作用.
12.氧族元素包括 ,其原子结构的共同点是 ,不同点是随着核电荷数的增加,原子核外电子层数 ,原子半径 ,原子获得电子的能 ,失电子的倾向 ,因此,氧族元素的金属性 ,非金属 性 .其中阴离子还原性最弱的是 , 氢化物最稳定的是 ,最高价氧化物对应的水化物酸性最强的是 .
13.有A—F六种气体,根据下列事实,判断各是哪一种气体?并写出有关反应的化学方程式:
①D极易溶于水;
②C、D、E、F的溶液的pH值小于7
③A在C中可燃烧,产生苍白色火焰,并生成D;
④将F在B中进行充分燃烧生成E和水蒸气,E能漂白有色的潮湿花朵.
(1)写出A—F的化学式:
A ,B ,C ,D ,E ,F ;
(2)写出有关反应的化学方程式
14.现有A、B两种化合物,具有如下性质:
(1)A B H2SO4 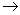 Na2SO4 S↓ H2O; (2)A H2SO4 Na2SO4 S↓ H2O; (2)A H2SO4 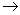 Na2SO4 G↑ H2O Na2SO4 G↑ H2O
(3)B H2SO4 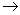 Na2SO4 E↑; (4)G E Na2SO4 E↑; (4)G E 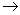 S↓ H2O; S↓ H2O;
(5)G I2 H2O 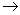 HI H2SO4. HI H2SO4.
根据以上事实推断(写化学式):A ,B , E ,G ;
写出上述有关反应的离子方程式(不是离子反应的写化学方程式):
(1) ;(2) ;(3) ;
(4) ;(5) .
[达标检测答案与提示]
1.AB 2.D 3.C 4.AD 5.D 6.A 7.D 8.A 9.B
 11.O3 O 2O2 催化 11.O3 O 2O2 催化
12.O、S、Se、Te、Po,原子最外层电子数都有6个、增多、增大、减弱、增 强,逐渐增强逐渐减弱,O2-,H2O,H2SO4
13.(1)H2、O2、Cl2、HCl、SO2、H2S
(2)H2 Cl2 2HCl2 H2S 3O2 2SO2 2H2O
14.Na2SO3、Na2S、H2S、SO2
  (1)SO32 2S2- 6H 3S↓ 3HCO(2)SO32- 2H SO2↑ H2O (1)SO32 2S2- 6H 3S↓ 3HCO(2)SO32- 2H SO2↑ H2O
  (3)S2- 2H H2S↑ (4)SO2 2H2S 3S 2HCO (3)S2- 2H H2S↑ (4)SO2 2H2S 3S 2HCO
 (5)SO2 2H2O I2 SO42- 4H 2I- (5)SO2 2H2O I2 SO42- 4H 2I-
|