| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
第一节 原子结构 一、 原子的组成与同位素 [知识结构] 一、元素、核素、同位素 1.概念比较 (1)元素是具有相同核电荷数(质子数)的同一类原子的总称;核素是具有一定数目的质子和一定数目的中子的一种原子;同一元素不同核素之间互称为同位素。 (2)标号为 2.同位素的性质 ① 同位素的性质化学几乎完全相同,是由于原子核外电于排布相同;物理性质不同,由于它们的中子数不同。 ② 在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子百分比一般不变。 二、构成原子的粒子及其性质
| 微粒种类
| 原子核
| 电子
| 质子
| 中子
| (1)电性和电量
| 每个质子带1个单位正电荷
| 不显电性
| 每个电子带1个单位负电荷
| (2)相对质量
| 1.007
| 1.008
| 1/1836
| (3)作用
| 质子数决定元素种类
| 中子数与质子数决定原子种类
| 核外电子数与核内质子数决定元素性质
| (4)数量关系
| ①在原子中:核电荷数=核内质子数=核外电子数 ②在阳离子中:核内质子数—核外电子数=所带电荷数 ③在阴离子中:核外电子数—核内质于数:所带电荷数 ④质子数 中子数=质量数;核素的近似相对原子质量 | |||||||||||||||||||||||||||||||||||||||||
三、几种相对原于质量计算方法。
1.核素的相对原子质量
以12C原于质量的1/12 作为标准,其他原于的质量跟他相比较所得的值。其国际单位制(SI)单位为l(单位1一般不写)。
即12m(核素)/m(12C) (填算式)。
2.核素的近似相对原子质量
因为原子的质量主要集中在原子核上,原子核是由质子、中子构成,且质于、中子的相对质量均为1,所以核素的近似相对原子质量等于核素的质量数。
3.元素的相对原子质量
元素的各种天然同位素(稳定)原子所占的原于个数百分比与各同位素原子的相对原子质量乘积的加和。
注:(1)元素或核素摩尔质量当以g·mol-1为单位时,数值上等于其相对原子质量。
(2)通常元素周期表中或相对原于质量表中提供的数据是指元素的相对原子质量 。
二、原子核外电子排布
[知识结构]
一、原子核外电子运动的特征
由于核外电子质量很小、运动空间很小、运动速率很快,核外电子的运动规律跟普通物体不
同,它们没有确定的轨道。我们不能同时准确地测定电子在某一时刻确定的轨道、所处的位置和运动的速率,也不能描画出它的运动轨迹,只能用电子云来描述原子核外电子运动状态。
二、原子核外电子的排布规律
核外电子是分层排布的,其排布规律是:
1.电子层最多容纳2n2(n为电子层数)个电子。
2.最外层电子数目不超过8个(K层为最外层时不超过2个)
3.次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
4。电子总是尽先排布在能量最低的电子层里,然后依次排布在能量较高的电子层里
(各电子层能量由低到高的顺序是:K<L<M<N<O<P<Q)。
以上四条是相互联系的,不能孤立地理解。
三、原子或离子的电子式、结构示意图
1.注意原子、离子电子式书写的差异。
(1)在书写原子的电子式时,只要在元素符号的周围用小黑点或小叉表示最外层电子,
如:氧原子电子式为·eq \o(\s\up 10(..),\s\do 4(..),O )....·。
(2)在书写离子的电子式时,简单阳离子用离子符号表示,如镁离子电子式为Mg2+;简单阴离子要用[ ],并在右上方标明所带电荷,如硫离子的电子式为[∶eq \o(\s\up 10(..),\s\do 4(..),S )....∶]2-。
2.原子或离子的结构示意图中,小圆圈和圆圈内的符号和数字表示原子核和核内质子数,
弧线表示电子层,弧线上的数字表示该层电子数。
[例1] 在1911年前后,新西兰出生的物理学家卢瑟福把—束变速运动的α粒子(质量数为4的带2个单位正电荷的微粒),射向一片极薄的金箔。他惊奇地发现,过去一直认为原子是“实心球”,而这种“实心球”紧密排列而成的金箔,大多数α粒子竟畅通无阻地通过,就像金箔不在那儿似的。但也有极少数的。粒子发生偏转,或被笔直地弹回。根据以上实验现象能得出关于金箔中Au原子结构的一些结论,试写出其中的三点:
(1) 原子中存在原子核,它占原于中极小的体积;
(2) 原子核带正电荷,且电荷数远大α粒子;
(3) 金原子核质量远大于α粒子。
[例2] 同位素在生产、科研和医疗诊断等方面有着十分广泛的用途。
1.某种蔬菜施含放射性同位素15N的氮肥,植物吸收后主要用于合成蛋白质。人食用该种蔬菜后,通过代谢15N最终出现在B中。
A.氨基酸 B.尿素 C.氨 D.蛋白质
2.医学上常给病人口服Na126I溶液来诊断甲状腺疾病。这是由于合成甲状腺激素的重要原料是 ( C )
A.铁 B.钙 C.碘 D.钠
[例3] 设某元素某原子核内的质子数为m,中子数为n,则下述论断正确的是 ( A )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原于质量为m n
C.若碳原于质量为Wg,此原子的质量为(m n)Wg;
D.核内中子的总质量小于质子的总质量
[例4] 有关核外电子运动规律的描述错误的是 ( C )
A.核外电子质量很小,在原子核外作高速运动
B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动
D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多
[例5] 电子总数相等的微粒种类很多。电子总数为10的微粒;
(1)单核离子有Na+ Mg2 Al3 N3- O2- F-等。
(2)多核离子有H3O NH4 CH5 OH- NH2- CH3-等。
(3)分子有Ne HF H20 NH3 CH4等。
[例6] 有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的。他在研究海水制盐时,往剩余的副产物苦卤中通人氯气后,发现溶液颜色变深,再经过进一步提取可得一种红棕色有刺鼻臭味的液体,这就是A元素的单质。B、C、D均属短周期元素;D的原子核内质子数是C原子核内质子数的2倍,且它们原子的最外层上电子数相等。B原子核外的电子数是D 原子的最内层上电子数的一半。则这四种元素分别为A Br、B H、C O、D S 。由上述某元素的单质与另两种元素的化合物反应生成两种酸的化学方程式为Br2 H2O === HBr HBrO。
[例7] 已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A钠B氧C硫 D硫 E氢。
(2)画出C元素的离子结构示意图 S2- 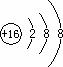 。
。
(3)写出下列物质的电子式:D元素形成的单质 ![]() ,E与B形成的化合物H∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶H或H∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶H,A、B、E形成的化合物Na+[∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶H ]—,D与E形成的化合物
,E与B形成的化合物H∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶H或H∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶H,A、B、E形成的化合物Na+[∶eq \o(\s\up 10(..),\s\do 4(..),O )....∶H ]—,D与E形成的化合物
H∶eq \o(\s\up 10(..),\s\do 4(..),\s\do14(H),N)....∶H。
(4)用电子式表示离子化合物A2B的形成过程:2Na× ·eq \o(\s\up 10(..),\s\do 4(..),O )....· ——→ Na [eq \o(\s\do 0(×),\s\do 3(·))eq \o(\s\up 10(..),\s\do 4(..),O )....eq \o(\s\do 0(×),\s\do 3(·))]2- Na 。
第二节 元素周期律
一、元素周期律
[知识回顾]
一、有关概念
1.原于序数:
按核电荷数由小到大的顺序给元素编的号,原子序数=核电荷数=核内质子数。
2.元素的金属性是指元素的原子失电子的能力,原子越容易失电子,元素的金属性越强;反之,元素的金属性越弱。元素的金属性的强弱,一般可以从它的单质跟水(或酸)反应置换出氢的难易程度,以及“它的最高价氧化物的水化物一一氢氧化物的碱性强弱”来判断。
素的非金属性是指元素的原子得电子的能力,原子越容易得电子,元素的非金属性越强;反之,元素的非金属性越弱。元素的非金属性的强弱,一般可以从它的最高价氧化物的水化物的酸性强弱或氢气生成气态氢化物的难易程度以及气态氢化物的稳定性来判断。
3. 两性氧化物是指既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物是与碱反应生成盐和水。
二、元素周期律
1、填表(以11号—18号元素为例元素性质的变化规律)
元素
11Na
12Mg
13A1
14Si
15P
16S
17C1
18Ar
(1)电子排布
电子层数相同,最外层电子数从1依次递增到8
(1)原子半径,
![]() 原子半径(递减)
原子半径(递减)
不可
比
(3)主要化合价
十1
十2
3
十4
—4
十5
—3
6
—2
7
—1
(4)金属性、非金属性
![]() 金属性(减弱),非金属性(增强)
金属性(减弱),非金属性(增强)
(5)单质与水或酸反
应置换氢难易
与水剧烈反应
与水加热缓慢反应
与酸反应,但速率比镁慢
______
__
(6)氢化物化学式
______
SiH4
PH3
H2S
HCl
__
(7)与H2化合的难易
程度
______
![]() 由( 难 )到( 易 )
由( 难 )到( 易 )
__
![]()
(8)氢化物稳定性
______
![]() 稳定性(增大)
稳定性(增大)
__
(9)最高价氧化物化
学式
Na20
MgO
Al2O3
SiO2
P205
S03
C1207
__
最高价
(10)化学式
Mg(OH)2
Mg(OH)2
H4Si04
H4Si04
H2S04
HCl04
__
氧化物
(11)酸碱性
强碱
中强碱
两性氢氧化物
弱酸
中强酸
强酸
最强酸(同周期)
__
对应水
化物
(12)变化
规律
![]() 碱性(减弱),酸性(增强)
碱性(减弱),酸性(增强)
__
2.元素周期律的内容:元素性质随着原子序数的递增而呈周期性的变化。即随着原子序数的递增:原子核外电子排布、原子半径、元素主要化合价、元素的金属性与非金属性呈现周期性的变化。
3.元素周期律的实质:元素性质周期性的变化是元素原子核外电子排布的周期性变化的必然结果。
[例1] 下列事实一般不能用于判断金属性强弱的是 ( B )
A.金属间发生的置换反应
B. 1mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应的水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢的难易
[例2] A、B、C、D、E是同周期的五种主族元素,A和B的最高价氧化物的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的水溶液均显酸性,且酸性C>D,五种元素形成的简单离子中,E离子的半径最小,则它们的原子序数由大到小的顺序为 ( A )
A. C、D、E、A、B B.E、C、D、A、B 、
C.A、B、D、C、E D.B、A、E、D、C
[例3] 铍的性质类似于铝,下列有关铍性质的推断正确的是 ( B )
A. 铍能与冷水反应
B. 氢氧化铍能与强酸、强碱溶液反应
C.氧化铍的化学式为Be203
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
二、元素周期表
[知识回顾]
一、元素周期表的结构
1.元素周期表的编排原则
按原子序数递增的顺序从左到右排列;将电子层数相同的元素排成一个横行;把电子层数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
2.元素周期表的结构
(1) 横行:每一横行称为一个周期。其中第1、2、3周期中包含的元素数目较少,叫做短周期;第4、5、6周期中包含的元素数目较多,叫做长周期;第7周期又叫做不完全周期。
(2)纵行:18个纵行构成16个族。分为7个主族,即由短周期和长周期元素共同构成的族
(IA—ⅦA);7个副族,即仅由长周期元素组成的族(IB-ⅦB);一个Ⅷ族即从左到右数第8、9、10三个纵行;一个零族即稀有气体元素。各族从左到右排列顺序为IA ⅡA ⅢB ⅣB VBⅥB ⅦB Ⅷ IB ⅡB ⅢA ⅣA VA ⅥA ⅦA 0。
(3)无机化学命名委员会在1989年作出决定:把长周期表原来的主副族取消,周期表从左到右改为18列,从左到右序号为1—18。含元素种类最多的是第3列,形成化合物最多的元素在第14列。
二、原子结构、元素性质、元素周期表中的位置三者之间的关系
1. 元素周期表中位置与原子结构的关系
原子序数=核内质子数;周期数=电子层数;主族序数=最外层电子数。
2.元素性质与原子结构的关系
一般来说,原子核外最外层电子数不满8个时,有达到8个电子稳定结构的倾向。设n为最外层电子数,当n<3时,原子易失去n个电子而形成稳定阳离子Xn (或与n个电子形成共用电子对,表现 n价),表现金属性;当n>4时,原子易得到(8—n)个电子而形成稳定阴离子X(8-n)-,表现非金属性。最外层电子与化合价有关,因此又叫价电子。
3.元素周期表中位置与元素性质的关系
性质
同周期(从左往右)
同主族(自上而下)
(1)电子层数
相同
从1递增到7
(2)最外层电子数
从1递增到8(第一周期例外)
相同
(3)原子半径
减小
增大
(4)金属性(原子失电子能力)
减弱
增强
(5)非金属性(原子得电子能力)
增强
减弱
(6)单质还原性
减弱
增强
(7)单质氧化性
增强
减弱
(8)最高价氧化物对应水化物的酸碱性
碱性减弱,酸性增强
酸性减弱,碱性增强
(9)非金属形成气态氢化物的难易程度
由难到易
由易到难
(10)气态氢化物的稳定性:
增强
减弱
(11)主要化合价
最高正价从 1递增到 7(O、F例外) 最低负价从第ⅣA—4递增到—1
相同
(12)离子半径
r(阴离子)减小
r(阳离子)减小
r(阴离子)> r (阳离子)
增大
三、元素周期律与元素周期表的意义
1.元素周期表是学习和研究化学的一种重要工具。元素周期表是元素周期律的具体表现形式,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。我们可以利用来指导我们对化学的学习和研究,如:原子结构、元素性质、元素在周期表中的位置三者之间的关系、预言未知元素、系统研究元素的性质等。
2.元素周期律和周期表对于工农业生产也有一定的指导作用。由于在周期表中位置
靠近寻找新物质的元素性质相近,这样,就启发人们在周期表中一定的区域内_发现新元素及预测它们的原子结构和性质。
3.元素周期律从自然学科方面有力地论证了事物变化中量变引起质变的规律性。
[例 1] 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原于序数不可
能是 ( B )
A.z 2 B.x 4 C.x 8 D.x 18
[例 2] 若短周期元素X、Y可形成原子个数比为2:3的化合物,则这两种元素的原子序数之
差不可能是 ( D )
A.1 B.3 G.5 D.6 .
[例 3] “北大富硒康”中含有微量元素硒(Se),对人体有保健作用。已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质为 ( A C )
A.硒化氢很稳定 B.硒化氢的水溶液显弱酸性
C.非金属性强于硫 D.其最高价氧化物的水化物酸性强于砷弱于溴
[例 4] 在周期表中,金属元素和非金属元素的分界线附近能找到 ( C )
A.制农药的元素 B.制催化剂的元素
C.制半导体的元素 D.制耐高温合金材料的元素
第三节 化学键与物质结构
一、离子键与离子化合物
[知识结构]
1. 化学键与分子间作用力的比较
化学键
分子间作用力
(1)概念
相邻的两个或多个原子间强烈的相互作用
物质的分子间存在的微弱的相互作用
(2)种类
离子键、共价键、金属键
——
(3)能量
一般为:120kJ·mol—l—800kJ·mol—l
约几个至几十个kJ·mol—l
(4)对物质性质的影响
主要影响物质的化学性质
主要影响物质的物理性质
2. 离子键和共价键的比较
键型
离子键
共价键
(1)概念
使阴、阳离子结合成化合物的静电作用
原子间通过共用电子对所形成的相互作用
(2)成键微粒
离子
原子
(3)形成条件
活泼金属与活泼非金属结合时形成离子键
非金属元素之间相互化合时易形成共价键
二、离子的结构与性质
1. 离子的结构特征
(1)离子电荷:离子所带的电荷就是原子在形成化学键时得或失的电子数,离子符号与标价符号不同。
(2)电子层结构:主族元素的离子电子层结构一般是饱和,副族和第VIII族元素的离子电子层结构一般是不饱和的。
(3)离子半径
① 同种元素不同价态微粒:电荷越高,半径越小。
如:r(H—) > r(H) > r(H ),r(Fe) > r(Fe2 ) > r(Fe3 )。
②等电子离子:随核电荷数的增大,离子半径减小。
如:r(N3—) > r(02—) > r(F—) > r(Na ) > r(Mg2 ) > r(A13 )
③同主族元素的同价态离子:随核电荷数的增大,离子半径减小。
如:r(Li ) < r(Na ) < r(K ) < (Rb ) < r(Cs )
④同周期元素的简单离子:阴离子半径大于阳离子半径。
如:r(S2—) > r(Cl—) > r(Na ) > r(Mg2 ) > r(Al3 )
2.离子的性质
离子和相应的原子由于结构不同,因此,性质也不同;金属原子只有还原性,而最高价金属离子只有氧化性,且金属的还原性越强,其对应阳离子的氧化性越弱;非金属原子一般具有氧化性,而最低价非金属离子只有还原性,且非金属原子氧化性越强其对应阴离子还原
性越弱。
[例 1] 下列化合物中阴离子半径和阳离子半径之比最大的是 ( A )
A.LiI B.NaBr C.KCI D,CsF
[例 2] 下列有关阳离子的说法中错误的是 ( D )
①阳离子都是由一个金属原子失去电子而形成的 ②非金属原子不能形成阳离子 ③阳离子的电子排布一定与稀有气体相同 ④阳离子的价态不会大于其原子的最外层电子数 ⑤阳离子都是稳定结构,不会再失去电子
A.①④ B.②④ C.①②③ D.①②③④⑤
[例 3] 下列说法正确的是 ( C D )
A.阴、阳离子间的相互吸引作用叫离子键
B.化学键只存在于分子之内,原子之间 :
C.一个阴离子可以同时与多个阳离子间有静电作用
D.分子内或晶体中,不相邻的原子问也存在相互作用但作用力较弱,不属于化学键
二、共价键与共价化合物
[知识结构]
一、共价键的概念、分类及表示方法
1. 共价键是原于间通过共用电子对所形成的相互作用。
2.根据形成共价键的数目可分为单键、双键_、三键 ;根据键的极性可分为极性键_、非极性键。
3.可以用电子式、结构式表示共价键。
(1)用电子式表示共价键,应根据原子最外层电子数,及各种原子形成相对稳定的结构时所需形成的共用电子对数书写电子式。
(2)用“电子式表示共价键的形成过程”,必须用“→”连接,“→”左边写原子的电子式,右边写物质的电子式。
(3)用一根短线表示一对共用电子对_的式子叫结构式。
二、键的极性与分子极性的判断
1. 由同种原子间形成的共价键是非极性键_;由不同种原子间形成的共价键是极性键。
2. 极性分子与非极性分子
(1)分子的极性由键的极性与分子的对称性_两方面共同决定。填表:
分子中原子数
类型
分子形状
分子的极性
代表物
2
①A2
直线型
非极性
H2、N2
②AB
极性
HCI、CO
3
③如A=B=A
直线型
非极性
C02、CS2
B
/\
④ A A
折线型
极性
4
⑤AB3
平面正三角型
非极性
BF3、BCl3
⑥AB3
三角锥型
极性
NH3
⑦A4
正四面体型
非极性
P4
5
⑧AB4
正四面体型
非极性
CH4、SiCl4
⑨AB3C
四面体型
极性
CH4、SiCl4
⑩AB2C3
四面体型
极性
CH2Cl2
(2)判断ABn型分子极性的经验规律;若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为_________分子;若不等,则为_________分子
三、相似相溶原理
非极性物质易溶于_________溶剂而难溶于_________溶剂;极性物质易溶于溶剂而难溶于_________ 溶剂。如苯____溶于植物油而______溶于水;HCl____溶于水而______溶于苯。
[例 1] 下列物质的电子式书写正确的是 ( C )
A.氨 ![]() B.氯化镁 Mg2 [:C1:] -2
B.氯化镁 Mg2 [:C1:] -2
C.氮气 ![]() D.二氧化碳
D.二氧化碳 ![]()
[例 2] 实验测得Be2Cl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,Be2Cl2属于 ( B )。
A.由极性键构成的极性分子 B.由极性键构虚的非极性分子
C.由非极性键构成的极性分子 D.由非极性键构成的非极性分子
[例 3] 将几种分子晶体在水和四氯化碳中的溶解情况填入下表:
蔗糖
磷酸
碘
萘
(1)水
易溶
易溶
不易溶
不易溶
(2)四氯化碳
不易溶
不易溶
易溶
易溶
三、晶体类型和晶体结构
[知识结构]
一、四大晶体的比较
晶体类型
离子晶体
原子晶体
分子晶体
金属晶体
1.构成微粒
阴、阳离子
原子
分子
金属离子、自由电子
2.微粒间作用力
离子键
共价键
分子间作用力(即范德华力)
金属键(即金属离子与自由电子间的静电作用)
3.熔沸点
较高
很高
一般较低
有的高、有的低
4.硬度
硬而脆
很硬
较小
一般较硬少数软
5.溶解性
一般易溶于极性溶剂,难溶于非极性溶剂
难溶于一般溶剂
极性相似相溶
难溶于一般溶剂(Na等与水反应)
6. 导
①晶体
不导电
不导电
不导电
导电
电
②熔融
导电
不导电
一般不导电
导电
性
③溶液
溶于水能导电
-
水溶液能导电
-
7.其它
难挥发,密度大
不挥发
大部分有挥发性
延展性、导热性好
8.实例
CaO、NaCl、KOH等
金刚石、Si02等
He、Cl2、C60、H20、H2S04、NH3·H2O、CH3CH20H等
Na、Mg、Al等
注:根据表中有关项目的比较,可以反推晶体类型。
二、晶体熔、沸点高低的比较
1.离子晶体:一般地化学式及结构相似时,阴阳离子的半径越小、电荷数越高,熔、沸点越高。如:KF > KCl > KBr > KI。
2.原子晶体:一般同种类型的原子晶体,原子半径越小,原子间距离越短,共价键越稳定,熔、沸点越高_。如:金刚石 > 二氧化硅 > 晶体硅。
3.金属晶体:金属原子的价电子数越多,原子或离子半径越小,金属阳离子与自由电子的静电作用越强,熔、沸点越高。合金的熔、沸点比它各成分纯金属的熔、沸点低。如:Na <_Mg <Al,Li > Na_> _K_> Rb > Cs。
4.分子晶体:组成和结构相似的分子晶体,相对分子质量越大,一般分子间作用力越大,物质的熔、沸点越高。如:F2_<_C12_< Br2 < I2。
三、常见晶体的空间结构
1. NaCl晶体结构由Na 和C1-各自构成的立方面心结构二者穿插而成。在每个Na 周围最近的等距离(设为a)的Cl-有6(上、下、左、方、前、后)个;在每个Cl-周围最近的等距离Na 有6个。在每个Na 周围最近的等距离的Na 有12(同层4个、上层4个、下层4个)个:在每个Cl-周围最近的等距离Cl-有12个。
2.CsCl晶体结构由Cs 和Cl-各自构成的简单立方结构二者穿插而成。在每个立方体的中心有一个异种离子(Cs或Cl-)。在每个Cs 周围最近的等距离的Cl-有_8个;在每个Cl-周围矗近的等距离的Cs 有8个。在每个Cs 周围最近的等距离的Cs 有6(上、下、左、右、前、后) _个;在每个Cl-周周最近的等距离的Cl-有6个。
3.干冰晶体结构中,在每个C02分子周围等距离最近的C02有12(同层4个、上层4个、下层4个)个。
4.金刚石晶是一种空间网状结构。每个C原子与另外4个C原子以共价键结合,前者位于正四面体的中心,后者位于正四面体的顶点,并以这种结构向空间发展,形成一种空间网状结构的晶体。晶体中最小碳环由6个C原子组成,且不在同一平面内。晶体硅的结构与金刚石相似。Si02的晶体结构可看作是在晶体硅的Si—Si键之间插入氧原子而形成的。
[例 1] 下列四种晶体①金刚石 ②氯化钠 ③干冰 ④钠,它们的熔点由低到高的顺序排列正确的是
A.④②③① B.③①②④ C.④②①③ D.③④②①
[答案] D
物质结构 元素周期律 单元测试题 (A)
1. 硼元素的平均相对原子质量为10.81,则硼在自然界中的两种同位素 ![]() ( D )。
( D )。
(A) 1:1 (B) 10:11 (C) 81:19 (D) 19:81
2.原子序数为47的银元素有2种同位素,它们的摩尔分数几乎相等,已知银的相对原子质量是108,则银的这两种同位素的中子数分别是 ( D )。
(A) 110和106 (B) 57和63 (C) 53和66 (D) 60和62
3.。在同温、同压下,相同物质的量的氢气和氦气,具有相同的 ( BC )。
(A) 原子数 (B) 质子数 (C) 体积 (D) 质量
4.关于同温、同压下等体积的N2O和CO2的叙述: ( D )。
①质量相同 ②碳原子数和氮原子数相等 ③所含分子数相等 ④所含质子总数相等
(A) ①②③ (B) ①③④ (C) ②③④ (D) ①②④
5.阴离子Xn-含中子N个,X的质量数为A,则WgX元素的气态氢化物中含质子的物质的量是 ( C )。
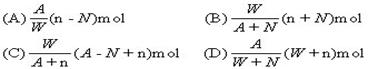
6.。列各组物质中都是由分子构成的化合物是 ( B )。
(A) CO2、NO2、SiO2 (B) HCl、NH3、CH4
(C) NO、CO、CaO (D) O2、N2、Cl2
7.根据下列各组元素的原子序数,可组成化学式为AB2型化合物且为原子晶体的是( B )。
(A) 14和6 (B) 14和8 (C)12和17 (D)6和8
8.下列微粒中,与OH-具有相同的质子数和相同的电子数的是 ( .AD )。
![]()
9.元素A、B、C原子核内质子数之和为31,最外层电子数之和为17,这三种元素是 ( C )。
(A) N、P、Cl (B) P、O、S (C) N、O、S (D) O、F、Cl
10.某元素原子核内质子数为m,中子数为n,则下列论断正确的是 ( A )。
(A)不能由此确定该元素的相对原子质量
(B)这种元素的相对原子质量为m n
(C)若碳原子质量为Wg,则此元素原子质量为(m n)Wg
(D)该元素原子核内中子的总质量小于质子的总质量
11.在下列晶体中,不能有配位键的是 ( .CD )。
(A)离子晶体 (B)分子晶体 (C)原子晶体 (D)金属晶体
12.x、y、z3种元素的离子具有相同的电子层结构,离子半径x>y,y与z可形成zy2型离子化合物,则3种元素的原子序数关系是 ( D )。
(A) x>y>z (B) y>x>z (C) z>x>y (D) z>y>x
13.下列晶体,其中任何一个原子都被相邻的4个原子包围,以其价键形成正四面体结构,并向空中伸展形成网状结构的是 ( C )。
(A) 甲烷 (B) 石墨 (C) 晶体硅 (D) 水晶
14.下列说法正确的是 ( D )。
(A)在周期表中,族序数都等于该族元素的最外层电子数
(B)非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
(C)同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大
(D)碱金属随原子序数的增大,其熔沸点逐渐降低;卤素单质随原子序数的增大,其熔沸点逐渐升高
15.某主族元素原子第六电子层上只有1个电子,其不可能具有的性质 ( BC )。
(A)该元素的单质极易被氧化
(B)该元素可形成共价化合物
(C)该元素只存在一种氧化物
(D)该元素的碳酸盐溶液具有明显的碱性
二、填空题![]()
![]()
件下发生化学反应,其生成物的化学式为FeCl3。
2. 把外层电子排布与氩原子的电子排布相同的两种阳离子和两种阴离子依其离子半径由小到大顺序排列为Ca2 < K < Cl- < S2-。这四种离子间形成离子化合物依其式量由小到大的顺序排列为CaS、KCl、K2S、CaCl2。
3. A 、B-、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A 和B-在加热时相互反应可转化为C和D。则A 的电子式为 ![]() ,B-的电子式为
,B-的电子式为 ![]() 。
。
4. 碳化硅(SiC)的一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替排列的。在下列晶体①金刚石②晶体硅③碳化硅中,它们的熔点由高到低的顺序是①③②。(用标号填写)![]()
中含10 mol质子,含12mol中子,含10×6.02×1023个电子。
6. A、B、C、D、E五种元素在周期表里的位置如下表所示:
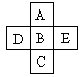
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是磷,在周期表第3 周期,第VA族,其原子结构示意图 ![]() 。
。
7. W、X、Y、Z四种元素都位于短周期内,它们的原子序数依次递增,W原子核内只有一个质子,X原子的电子总数与Z原子的最外层电子数相等,W原子与X原子的最外层电子数之和与Y原子的最外层电子数相等。Z原子的最外层的电子数是次外层电子数的3倍,且Z只能形成阴离子。由此推出它们的名称是:X是碳,,Y是氮,,Z是氧,W是氢,。已知W、X、Y、Z可组成一种化合物,其原子个数比为4:1:2:1,该化合物的名称是尿素。
8. A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A Na;,D Si,E P。
(2)用电子式表B、F形成的化合物 ![]() 。
。
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 ![]() 。
。
(4)D的固态氧化物是原子晶体。含nmolD的氧化物的晶体中含D-O共价键为4n mol。
9. 已知有关物质的熔、沸点数据如下表:
MgO
Al203
MgCl2
AlCl3
熔点/℃
2852
2072
714
190(2.5x105Pa)
沸点/℃
3600
2980
1412
182.7
请参考上述数据回答下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al203,与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产金属镁,也不用电解AlCl3的方法生产金属铝?
因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,不便于操作。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,熔融时难导电,不能被电解。
(2)上述化合物的晶体属于离子晶体的是MgO Al203 MgCl。
(3)下列实验能证明某化合物属于共价化合物的是B。
A.熔融状态能导电 B.熔融状态不导电 C.水溶液能导电
三、计算题
1.AxByCz是由A、B、C三种处于不同短周期元素组成的化合物。已知:
(1) x、y、z均为整数,且x y z=13;
(2) 取0.05mol该化合物与过量的水反应产生2.4g气体M,同时生成0.05mol白色胶状沉淀R,R既能溶于NaOH溶液,又能溶于盐酸;
(3) 同温同压下,20mL由B、C两种元素组成的M气体,完全燃烧需要40mL氧气,燃烧产物为二氧化碳和水。
通过计算和推理可知,三种元素的名称分别是A铝、B碳、C氢,气体M的化学式是CH4,AxByCz的化学式是AlC3H9,AxByCz与水反应的化学方程式为AlC3H9 3H2O=3CH4↑ Al(OH)3↓ 。
物质结构 元素周期律 单元测试题 (B)
1.正电子、反质子等都属于反物质粒子,它们跟普通电子、质子的质量、电量相等,而电性相反;它们在和普通电子、质子等相遇时会发生湮灭,同时放出大量能量。为探测宇宙中是否存在“反物质”和“暗物质”,1998年6月,由诺贝尔物理奖获得者丁肇中教授领导的多国科学小组,将α—磁谱仪(中国科学家承担了其关键部件水磁体的研究制造)送入太空。下列有关叙述正确的是 ( BC )
A.地球上存在大量的反物质粒子 B.反氢原子由l个反质子和1个正电子构成 C.反物质可用于开发新能源 D.反中子的质量为0
2.氯只有35C1和37C1两种稳定同位素,它们在氯气中的原子数之比为3∶1。则相对分子质量为70、72、74的氯气分子数之比可能是 ( C )
A.5∶2∶1 B.5∶2∶2 C.9∶3∶1 D.9∶3∶2
3.某氯原子的质量ag,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是( A )
A.氯元素的相对原子质量为12a/b
B.mg该氯原子的物质的量一定是m/(aNA)mol
C.该氯原子的摩尔质量是12aNAg
D.ng该氯原子所含的电子数为17n/a
4.已知KClO3与浓HCI反应的化学方程式为:KClO3 6HCl=KCl 3C12 3H2O若用K35C1O3与H37Cl作用,则下列说法正确的是 ( BD )
A.所得氯气的相对分子质量约为71
B.KCl中只含37C1
C.KCl中既含35C1又含37Cl
D.被氧化和被还原的氯原子数之比为5∶1
5.下列各组微粒中,各电子层电子数均达到2n2个的是 ( B )
A.Ne、Ar B.H—、Na C.Ne、C1— D.F—、S2—
6.某元素的原子,最外电子层上只有2个电子,该元素 ( .D )
A.一定是ⅡA族元素 B.一定是金属元素
C.一定是 2价元素 D.可能是金属元素,也可能不是金属元素
7.下列各组微粒具有相同质子数和电子数的是 ( C )
A.CH4、NH3、H2O、Ar B.OH—、F—、O2—、Ne
C.H3O 、NH4 、Na 、H2F D.O2—、F—、Mg2 、A13
8. X、Y、Z和R分别代表四种元素。如果aXm 、bYn ,cZn-、dRm—四种离子的电子层结构相同 (a、b、c、d为元素的原子序数)。则下列关系正确的是 ( .D )
A.a-c=m-n B.a-b=n-m C.c-d=m n D.b-d=n m
9.下列分子中所有原子都满足最外层8电子结构的是 ( A )
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
10.X、Y、Z周期表中相邻的三种元素。已知X和Y是同主族,Y和Z同周期,它们最外层上的电子数之和为16,则这三种元素可能是 ( B )。
(A)Na、K、Ca (B)N、P、S (C)N、P、Si (D)F、Cl、S
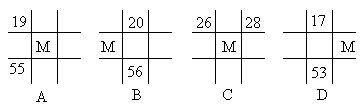
11.下列各图为周期表的一部分。表中数字为原子序数,其中M为37的是 ( B )。
12.A、B两元素可形成AB型离子化合物,如果A、B两种离子的核外电子数之和为20,则A、B两元素所处的周期为 ( C )。
(A)在同一周期
(B)一种在第一周期,一种在第二周期
(C)一种在第二周期,一种在第三周期
(D)一种在第三周期,一种在第四周期
13.同主族元素所形成的同一类型化合物,往往其结构和性质相似。化合物碘化磷(PH4I)是一种晶体,下列对它的叙述中错误的是 ( D )。
(A)它是一种含有配位键、共价键的离子化合物
(B)这种化合物加热时可能产生有色气体
(C)这种化合物的水溶液呈酸性
(D)这种化合物不能与烧碱发生反应
14.X、Y为元素周期表中处于相邻周期的两元素,它们原子核内质子数之和为21,Y原子的核外电子数比X原子的核外电子数多5个,试判断下列描述正确的是 ( AC )。
(A)X元素的原子易形成由非极性键结合组成的X单质的分子
(B)X元素的单质是一种原子晶体
(C)由这两种元素构成的一种阴离子与稀盐酸反应可能转化为Y的一种阳离子
(D)X元素跟硫元素只能构成一种由极性键结合的化合物
15.有关晶体结构的叙述中,错误的是 ( B )
A.金刚石的网状结构中,最小的环上有六个碳原子
B.在氯化钠晶体中,每个钠离子周围都紧邻6个钠离子
C.在金属钢的晶体中,由于存在自由电子,因此铜能导电
D.分于晶体熔化时,不破坏共价键;原子晶体熔化时破坏共价键
二、填空题
1.许多元素都存在同位素,目前已发现的110多种元素中,稳定同位素约300种,而放射性同位素达1500种以上。而且大多数是人工制备的。同位素在生产、生活和科研中有着十分广泛的用途,比如:测定矿石、生物遗体的年代,研究反应机理,优良育种、临床治癌,核动力发电等。
(1) 物质的量的单位摩尔是以0.012 kg 12C所含的原子个数为标准,有机化学中研究酯化
反应机理时用14C原子做示踪原子。
(2) 14C具有放射性,其半衰期为5686年。空气中12C与14C的存量比约为1012∶1.2,活着的生物体内碳的这两种同位素的存量比与空气中相同。生物死亡后,不再吸收碳。如果测得某古代生物遗骸中12C与14C的存量比约为1012∶0.6,估算该遗骸为5686 年前的生物遗留下来的。
2.1H(H)、2H(D)、3H(T)可组成6种H2;与16O、18O能形成12种水分子,有7种不同的相对分子质量;能形成18种H2O2分子。
3.有若干克某金属,其各原子核内共有3.5×6.02×1023个中子,同质量的该金属和稀硫酸反应共有0.2mol电子发生转移,生成6.02×1022个阳离子,这些阳离子共有3.0×6.0×1023个质子,则该金属的摩尔质量为65 g/mol (不考虑它的同位素),单个原子核内有30个质子,35个中子,其原子组成符号为3065Zn。
4.原子核外N层最多可容纳32个电子,当N层为最外层时最多可容纳8个电子;当N层为次外层时最多可容纳18个电子。
5.下列各题中的物质均由核电荷数为1~10的元素组成,按要求填空。
(1)只由两个原子核和两个电子构成的分子,其化学式是 H2 。
(2)一个最外层有4个电子的原子和2个最外层有6个电子的原子结合的分子,其电子式为 ![]() 。
。
(3)一个最外层有5个电子的原子和3个只有1个电子的原子结合的分子,其分子式为NH3,,分子是三角锥形构型,属极性分子。
(4)由3个最外层是6个电子的原子结合而成的分子,其分子式为O3, ,画出其原子结构示意图 ![]() 。
。
6.在一定条件下有下列反应:RO3n— 6I— 6H =R— 3I2 3H20发生。
(1)RO3n—中R元素的化合价是 5;(2)R原子最外层电子数是7 。
7.按要求回答下列问题
(1)石墨晶体中C-C键的键角为120°。其中平均每个六边形所含的C原子数为2 个。
(2)金刚石晶体中含有共价键形成的C原子环,其中最小的C环上有3/2个C原子。
(3)白磷分子中的键角为60°,分子的空间结构为正四面体,每个P原子与3个P原子结合成共价键。若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合6个氧原子。
(4)二氧化硅是一种原子晶体,每个硅原子周围有4氧原子。
8.BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构③BGO可看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是Ge和Bi。
(2)BGO晶体中所含铋的氧化物的化学式是Bi2O3 。
(3)BGO晶体的化学式是Bi4(GeO4)3。
9、已知X和Y均为短周期元素,单质X在空气中点燃,能发出耀眼的白光。在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如框图所示),已知气体G与氢气密度之比约为8.5。

①组成单质X和Y的元素分别属第_IIA族和第_IVA_族。
②化合物Z的化学式为Mg3N2。
10、(1)下图为固态CO2的晶体结构示意图。通过观察分析,可得出每 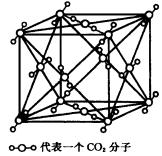 个CO2分子周围与之紧邻等距的CO2有12个。
个CO2分子周围与之紧邻等距的CO2有12个。
(2)试判断:①SiO2,②CO2,③CS2
晶体的熔点由高到低排列的顺序是 ①③②。(填相应物质的编号)。
| |