| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
一、选择题(本题包括13个小题,每小题3分,共39分;每小题只有一个选项符合题意。) 1.吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如 A 还原剂 B 氧化剂 C 既是氧化剂,又是还原剂 D 以上均不是 2.最近医学界通过用放射性14C标记的C60,发现一种羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制爱滋病(AIDS),则有关14C的叙述正确的是 A 与C60中普通碳原子的化学性质不同 B 与14N含的中子数相同 C 是C60的同素异形体 D 与12C互为同位素 3.原子半径可以纳米(nm)为单位。1nm=10-9m,相当于头发丝的1/10000。下列是氮、镁、氟、氯元素的原子半径数据,其中氟原子半径是 A 0.071nm B 0.075nm C 0.099nm D 0.16nm 4.在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别 A 酚酞试液 B 氯化钡溶液 C 氢氧化钠溶液 D 硝酸银溶液 5.用石灰水保存鲜蛋是一种化学保鲜方法,这种保存鲜蛋方法的原理是 ① 石灰具有强碱性,杀菌能力强 ② Ca(OH)2能与鲜蛋呼出的CO2反应,生成碳酸钙薄膜,起保护作用 ③ 石灰水是电解质溶液,能使蛋白质凝聚 ④ 石灰水能渗入蛋内中和酸性物质 A ①② B ①③ C ②③ D ③④ 6.在通信网中必不可少的材料是化合物半导体。现在最为普及的有两种化合物半导体,一种是镓砷半导体,它用作为便携电话和无线电通信发射微波的零件。另一种化合物半导体由比镓(Ga)多18个电子的元素A和与砷同族且电子层比砷少一层的元素B组成,它是作为通信电缆中将光信号转变为电信号的中继器零件。则此化合物的化学式为 A GaP B AlP C GaAs D InP 7.将固体MnC2O4·2H2O放在坩锅里加热,固体质量随温度变化的数据如下表:
| 温度/℃
| 25
| 50
| 75
| 100
| 214
| 280
| 固体质量/g
| 17.9
| 17.9
| 16.0
| 14.3
| 14.3
| 7.15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
下列说法错误的是(MnC2O4摩尔质量143g/mol)
A 25℃~50℃,MnC2O4·2H2O未发生变化 B 75℃时,MnCO4·2H2O部分失去结晶水
C 100℃时,坩锅内固体均为MnC2O4 D 200℃时,坩锅内固体为混合物
8.一种离子与多种酸根离子构成的盐称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl];而“复盐”则是指含有多种简单阳离子和一种酸根阴离子的盐,如KAl(SO4)2。据此,下列各化合物中属于混盐的是
A (NH4)2Fe(SO4) B CaOCl2 C BiONO3 D K3[Fe(CN)6]
9.把a升含(NH4)2SO4和NH4NO3的混和溶液分成两等份,一份加入b摩烧碱并加热,恰好将全部NH4+转变成NH3放出;另一份需含c摩BaCl2溶液恰能完全沉淀SO42-,则原溶液中NO3-的物质的量浓度是
A (2b-4c)/a摩/升 B (b-2c)/a摩/升 C (2b-c)/a摩/升 D (b-4c)/a摩/升
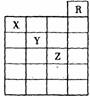 10.右图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是
10.右图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐 ②Y原子半径比氧原子或氢原子都大 ③Z的单质常温下可与铁粉反应 ④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素
A 只有③ B 只有①④ C 只有①②③④ D ①②③④⑤
 11.已知NaHS、MgSO4、NaHSO3组成的混和物中,硫元素的质量分数为a%,则混和物中氧元素的质量分数为
11.已知NaHS、MgSO4、NaHSO3组成的混和物中,硫元素的质量分数为a%,则混和物中氧元素的质量分数为
A a% B 2a% C 1-0.0175a D 1-0.0075a
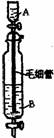
12.Inorganic Syntheses一书中,有一如右图所示装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
A A中装浓硫酸,B中装浓盐酸 B A中装浓盐酸,B中装浓硫酸
C A中装氢氧化钠浓溶液,B中装浓氨水 D A中装浓氟水,B中装氢氧化钠浓溶液
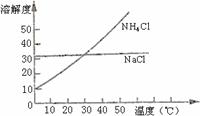 13.把NH4Cl从几乎饱和NaHCO3溶液中分离出来是联合制碱法中的关键。为此,应向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不含NaHCO3的NH4Cl。NH4Cl和NaCl共同存在时的溶解度曲线如右图所示,下列操作正确的是
13.把NH4Cl从几乎饱和NaHCO3溶液中分离出来是联合制碱法中的关键。为此,应向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不含NaHCO3的NH4Cl。NH4Cl和NaCl共同存在时的溶解度曲线如右图所示,下列操作正确的是
组别
通入气体
控制温度
A
CO2
30℃—40℃
B
CO2
0℃—10℃
C
NH3
30℃—40℃
D
NH3
0℃—10℃
二、选择题(本题包括7个小题,每小题4分,共28分;每小题有一个或二个选项符合题意;若有二个选项符合题意,只选一个正确选项,得2分,多选或选错该小题答0分。)
14.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
A CH3COO- B SO32- C CO32- D HCO3-
15.如果假设12C的相对原子质量为24,且以0.024kg 12C所含有的原子数为阿伏伽德罗常数,则下列数值中肯定不会因此而改变的是
A 标准状况下氧气的密度 B 气体摩尔体积
C 一个Cl原子的质量 D 一定质量硫酸中氧原子的物质的量
16.氡(Rn)是放射性元素,某些建筑材料中若含有氡,将对人体健康造成危害。222Rn来自镭而称之为镭射气,220Rn来自钍而称之为钍射气,219Rn来自锕而称之为锕射气。下列有关氡的说法正确的是
A 氡气是双原子分子 B 氡元素有222Rn、220Rn、219Rn三种同素异形体
C 氡气因其化学性质活泼而对人体有害 D 氡的原子核外有6个电子层,最外层有8个电子
17.1999年曾报道合成和分离了含高能量的正离子N5+化合物N5AsF6,下列叙述错误的是
A N5+共有34个核外电子 B N5+中氮—氮原子间以共用电子对结合
C 化合物N5AsF6中As化合价为+1 D 化合物N5AsF6中F化合价为-1
18.在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻。甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中正确的是
A 原子半径:丙>乙>甲>丁 B 乙和甲或乙和丁所能形成的化合物都是大气污染物
C 气态氢化物的稳定性:甲>丙 D 最高价氧化物对应水化物的酸性:丁>甲
19.有一金属钠和过氧化钠的混和物,与过量水充分反应后,产生2.24L气体(标准状况),用电火花点燃后,恢复到标准状况,体积减少了1.12L,则原混和物中钠与过氧化钠的物质的量之比为
A 1︰3 B 5︰1 C 1︰1 D 1︰2
20.下列离子方程式书写错误的是
A 氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B 氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C 过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
D 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
三、简答题(包括5小题,共33分)
21.(5分)纳米材料的特殊性质的原因之一是由于它具有很大的比表面积(S/V)即相同体积的纳米材料比一般材料的表面积大很多。假定某种原子直径为0.2nm,则可推算在边长1nm的小立方体中,共有
个原子,其表面有 个原子,内部有______个原子。由于处于表面的原子数目较多,其化学性质应 (填“很活泼”或“较活泼”或“不活泼”)。利用某些纳米材料与特殊气体的反应可以制造气敏元件,用以测定在某些环境中指定气体的含量,这种气敏元件是利用了纳米材料具有的 作用。
22.(6分)一固体混和物,可能有氯化钙、碳酸铵、烧碱、硫酸铵,将它溶解于水得到无色澄清溶液,无其它明显现象,向溶液中加入硝酸钡溶液,产生白色沉淀,再加入硝酸,沉淀部分消失,原混和物中肯定有 ,肯定没有 。
23.(6分)低标号普通水泥,由于烧结温度不够,致使其中掺杂了一些原料成分。某化工厂用这种水泥修筑了一个贮酸池贮存盐酸,池的内部涂以耐酸涂料,再加上施工质量不理想,贮酸一定时间后,出现了涂料膜与水泥壁之间充满气体,该气体的主要成分是 ,该气体的来源是 。一段时间后测定池内盐酸的浓度降低了但溶液的密度却升高了,取出部分贮存液用氢氧化钠溶液中和至碱性后通入CO2出现大量白色沉淀,试分析贮后酸液密度升高的原因 。
24.(6分)利用利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为2H2O ![]() 2H2+O2,其循环过程分三步进行:
2H2+O2,其循环过程分三步进行:
① SO2+I2+H2O→A+B ② A→?+? ③ B→?+?+?
(1)完成以上三步反应,并确定哪步反应最难进行。
(2)请对硫-碘热循环法制取氢的优劣和前景作一分析。
25.(10分)已知IOH是两性化合物,根据它的性质试回答:
(1)写出IOH的两性电离的方程式:
(2)完成下列化学方程式:
①.IOH+NaOH:
②.IOH+HCl:
③.IOH+H2S:
④.IOH+KMnO4+H2SO4:
四、推断题(共1题,共12分)
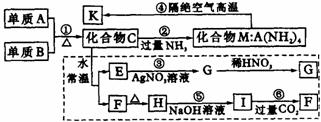 26.(12分)材料科学是近年来与化学有关的科学研究的热点。某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是以中学化学中常见物质为原料来生产的,下图虚线框外为其生产的过程;虚线框内的其他转化是为探究C的组成而设,G、F、H均为难溶于水的白色固体;图中C、M、K均含A元素,其余物质均为中学化学中常见物质。请回答下列问题:
26.(12分)材料科学是近年来与化学有关的科学研究的热点。某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是以中学化学中常见物质为原料来生产的,下图虚线框外为其生产的过程;虚线框内的其他转化是为探究C的组成而设,G、F、H均为难溶于水的白色固体;图中C、M、K均含A元素,其余物质均为中学化学中常见物质。请回答下列问题:
(1)K的化学式是 ,可能所属的晶体类型 。
(2)写出指定物质的化学式:C: ,F: 。
(3)写出图中下列序号的离子方程式:
反应③ ;反应⑤ 。
(4)写出反应④的化学方程式: 。
五、实验题(共2小题,20分)
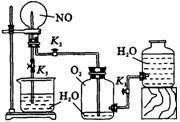 27.(12分)某学生设计了一套验证物质化学性质的实验装置(如右图所示,其中有1处错误)。请完成下列问题:
27.(12分)某学生设计了一套验证物质化学性质的实验装置(如右图所示,其中有1处错误)。请完成下列问题:
(1)该实验目的是 。
(2)该实验的原理是(用化学方程式表示)
。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡皮管、橡皮塞以及若干玻璃管连件外,还有 ,实验所用试剂为 。
(4)实验步骤:
①按右上图连接好仪器。
②扭开活塞K1和K2,主要现象为 。
③关闭活塞K1和K2,打开止水夹K3,可能出现的现象为 。
(5)指出该套实验装置的错误之处: 。
28.(8分)有Ba(OH)2、NaHSO4、NaHCO3三种溶液,已知其中两种溶液的物质的量浓度相同,且分别为另一种溶液的物质的量浓度的2倍;若先将NaHSO4和NaHCO3溶液各 100 mL混合反应后,再加入Ba(OH)2溶液100mL,充分反应后,将生成的白色沉淀滤出,测得滤液中只含一种NaOH溶质,其物质的量的浓度为0.9mol/L(不考虑溶液混和时引起溶液体积的变化),试回答:
(1)通过分析,判断原Ba(OH)2、NaHSO4、NaHCO3三种溶液中哪两种溶液的物质的量的浓度不可能相同? ,原因是 。
(2)计算Ba(OH)2、NaHSO4、NaHCO3三种溶液可能的物质的量的浓度。
五、计算题(共2小题,18分)
29.(8分)KClO3和MnO2混和物20.95g,加热到质量不再减少时为止,剩余固体16.15g,向剩余物中加入过量浓硫酸可放出气体,该气体与过量KI反应,生成的I2用Na2S2O3溶液吸收:I2+2Na2S2O3=2NaI+Na2S4O6。计算当把生成的I2全部吸收时需1mol/L的Na2S2O3溶液多少体积。
30.(10分)将ag H2与bg Cl2充分混合后,点燃使其充分反应。然后将反应后的混合气用足量的氢氧化钠溶液吸收
(1)写出可能发生的反应的化学方程式:
(2)若H2与Cl2恰好充分反应,只生成HCl,则生成NaCl的物质的量为 ,或 。
(3)若H2过量,则剩余气体质量为 ,生成NaCl的质量为 。
(4)若Cl2过量,则生成的NaCl的质量为 。
2004年温州市高一化学竞赛模拟试卷参考答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
A
D
A
D
A
D
D
B
A
C
C
B
D
A
A、C
D
C
C
B、D
A、B
21、125 98 27 很活泼 吸收(各1分)
22、 (NH4)2SO4 (NH4)2CO3(各1分) CaCl2 NaOH(各1分)
23、CO2;水泥中的碳酸盐和盐酸反应;贮后酸液含有氯化钙(各1分)
24、(1)① SO2+I2+H2O=2HI+H2SO4 ② 2HI=H2+I2 ③ 2H2SO4=2SO2+O2+2H2O 反应③最难进行(4分) (2)该循环过程需要很高的热能,也就是说在较高温度下才能进行,生成的SO2和I2可以循环使用,其它产物对环境无污染,但耗能太大,所以此法也不可取,若把太阳能用到上述循环中,该工艺将是合理的。(2分)
25、 (1)I++OH- ![]() IOH
IOH ![]() H++OI-(2分) (2)①.2IOH+NaOH=NaOI+H2O(1分) ②.IOH+HCl=ICl+H2O(1分) ③.IOH+H2S=S↓+HI+H2O(1分) ④.10IOH+8KMnO4+7H2SO4=8KIO3+Mn(IO3)2+7MnSO4+12H2O或10IOH+8MnO4-+14H+=10IO3-+8Mn2++12H2O(1分)
H++OI-(2分) (2)①.2IOH+NaOH=NaOI+H2O(1分) ②.IOH+HCl=ICl+H2O(1分) ③.IOH+H2S=S↓+HI+H2O(1分) ④.10IOH+8KMnO4+7H2SO4=8KIO3+Mn(IO3)2+7MnSO4+12H2O或10IOH+8MnO4-+14H+=10IO3-+8Mn2++12H2O(1分)
26、(1)Si3N4 原子晶体(2分) (2)SiCl4 H4SiO4(或H2SiO3)(2分) (3)③Ag++Cl-=AgCl↓(1分) ⑤SiO2+2OH-=SiCl4+H2O(1分) (4)3Si(NH)4 ![]() Si3N4+8NH3(1分)
Si3N4+8NH3(1分)
27、(1)验证NO与O2反应 NO2与H2O反应(各1分) (2)2NO+O2=2NO2 3NO+H2O=2HNO3+NO(各1分) (3)烧瓶(或圆底烧瓶),大烧杯(1分) NO,O2和H2O(1分) (4)②盛NO的烧瓶内出现红棕色 ③出现喷泉(各1分) (5)储气瓶内导管露出瓶口即可(1分)
28、(1)NaHSO4与NaHCO3这两种溶液的物质量的浓度不可能相同(1分);原因是当这两种物质的物质量的浓度相同时,最后的溶液中必有硫酸根离子,不可能只剩下氢氧化钠(1分) (2)有两种可能。第一种可能是c(Ba(OH)2)=c(NaHSO4)=1.8mol/L,c(NaHCO3)=0.9mol/L。第二种可能是c(Ba(OH)2)=c(NaHCO3)=1.8mol/L,c(NaHSO4)=0.9mol/L。(各组2分)
29、 2KClO3 ![]() 2KCl+3O2↑ n(KClO3)=n(KCl)=0.1mol(2分) n(MnO2)=0.1mol
2KCl+3O2↑ n(KClO3)=n(KCl)=0.1mol(2分) n(MnO2)=0.1mol
2Cl-+MnO2+4H+=Mn2++Cl2↑+2H2O Cl2+2I-=2Cl-+I2 I2+2S2O32-=2I-+S4O62- Cl-~S2O32-(4分) n(S2O32-)=n(Cl-)=0.1mol 即:100mL(2分)
30、(1)①H2+Cl2 ![]() 2HCl ②HCl+NaOH=NaCl+H2O ③Cl2+2NaOH=NaCl+NaClO+H2O(2分) (2)a mol b/33.5mol(2分) (3)2(a/2-b/71)g 58.5b/35.5g(2分) (4)58.5(a/2-b/71)g(2分)
2HCl ②HCl+NaOH=NaCl+H2O ③Cl2+2NaOH=NaCl+NaClO+H2O(2分) (2)a mol b/33.5mol(2分) (3)2(a/2-b/71)g 58.5b/35.5g(2分) (4)58.5(a/2-b/71)g(2分)
| |