|
高一年级上学期期中考试
化学试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分100分,考试时间90分钟。注意:将第Ⅰ卷选择题答案填涂在机读卡上,
以下数据可供解题时参考:可能用到的元素相对原子质量:
H — 1;Na — 23;O — 16;Cl — 35.5;S — 32;; C — 12; N — 14
第Ⅰ卷 选择题( 共60分)
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个正确答案)
1.氧化还原反应的实质是( )
A.反应中有电子得失或电子对的偏移 B.反应中有氧原子的得失
C.元素化合价发生变化 D.反应后生成新的物质
2.下列微粒中,不具有还原性的微粒是( )
A.H2 B.H C.HCl D.S2-
3.下列有关氧化还原的叙述,正确的是( )
A.置换反应一定属于氧化还原反应
B.非金属单质在反应中只作为氧化剂
C.得电子越多的氧化剂,其氧化性越强
D.化合反应和复分解反应不可能是氧化还原反应
4.能用离子方程式H + OH-=H2O表示的化学方程式是 ( )
A. Ba(OH)2 + H2SO4=BaSO4¯ + 2H2O B. KOH + HCl=KCl + H2O
C. Cu(OH)2 + H2SO4=CuSO4 + 2H2O D. 2NaOH + H2S=Na2S + 2H2O
5. 氢化钙可作为生氢剂,反应的化学方程式为: CaH2 + 2H2O=Ca(OH) 2 + 2H2↑,下列说法错误的是 ( )
A.CaH2是还原剂,H2O是氧化剂 B.H2既是氧化产物,又是还原产物
C.CaH2既是氧化剂,又是还原剂 D.氧化产物与还原产物的质量比为1∶1
6. 已知:①2FeCl3 2KI = 2FeCl2 2KCl I2 ②2FeCl2 Cl2 = 2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
A.I2>Cl2>FeCl3 B.FeCl3>Cl2>I2 C.Cl2>I2>FeCl3 D.Cl2>FeCl3>I2
7.在溶液导电性实验装置里,分别注入20mL同浓度的醋酸和氨水,灯光明暗程度相似。若把两种溶液混合后再试验,则( )
A.明暗程度几乎不变 B.灯光变暗 C.完全不变 D. 灯光变亮
8.下列离子方程式书写正确的是( )
A.在Na2CO3溶液中逐渐滴入少量的稀盐酸:CO32- 2H ==H2O CO2↑
B.CaCO3与稀HCl反应制备CO2:CO32- 2H ==H2O CO2↑
C.向澄清石灰水中通二氧化碳 Ca2 2OH- CO2 = CaCO3↓ H2O
D.铁与稀硫酸反应制备H2:Fe+2H+= Fe3++H2↑
9. 据报道,某国一集团拟在太空建造巨大的集光装置,把太阳光变成激光用于分解海水制
氢气:2H2O === 2H2↑ O2↑ 下列说法不正确的是( )
A. 水的分解反应是放热反应
B. 反应物所具有的总能量低于生成物所具有的总能量
C. 使用氢气做燃料有助于控制温室效应
D. 氢能源将是21世纪中后期最理想的能源
10. 在同一稀溶液中可以共存,加OH -有沉淀生成的一组是( )
A. Na 、CO32-、Ca2 、Cl - B. OH-、Na 、SO42-、H
C. K 、Cl -、SO42-、Na D. Ba2 、HCO3-、Cl -、Na
11. 一定条件下RO3n-和氟气发生反应:RO3n- F2 2OH - = RO4- 2F - H2O从而可知RO3n-中元素R的化合价是( )
A. 4 B. 5 C. 6 D. 7
12. 反应8NH3 + 3Cl2 === 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的质量比是( )
A. 3:1 B. 1:3 C. 1:1 D. 3:8
13.除去Na2CO3 固体中少量的NaHCO3最佳方法是( C )
A.加入适量盐酸 B.加入NaOH溶液 C.加热灼烧 D. 配成溶液后通入CO2
14.下列比较不正确的是( )
A.熔点:Li>Na>K B.热稳定性:Na2CO3>CaCO3>NaHCO3
C.密度:煤油<Li<Na<H2O D.还原性:Li<Na<K
15.下列关于碱金属化学性质的叙述中,错误的是( )
A. 它们都能在空气中燃烧生成过氧化物
B. 碱金属都能与水反应生成氢气和对应的碱
C. 碱金属元素的化合价在化合物中总是 1价
D. 它们都是强还原剂
16.关于Na2CO3和NaHCO3的说法正确的是( B )
A.在水中的溶解性:NaHCO3>Na2CO3
B.与同一种且质量分数相同的盐酸溶液反应的速率:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.Na2CO3是小苏打,而NaHCO3是苏打
17.用光洁的铂丝蘸取某无色溶液,在无色灯焰上灼烧,观察到黄色火焰,则下列有关该无色溶液的叙述正确的是:( B )
A.只含有Na B. 可能含Na 或K 的一种
C.一定含有Na 和K D.一定含Na ,也可能含K
18. 在通常情况下,下列物质因发生氧化还原反应而变质的是( )
A. Na2O2 B. Na2CO3 · 10H2O C. NaOH D. Na2O
19. 关于Na的描述正确的是( )
①Na在自然界既有游离态又有化合态存在 ②金属Na着火可以用泡沫灭火器救火 ③实验室中少量的Na保存在煤油里 ④Na-K合金做原子反应堆的导热剂 ⑤Na比Cu活泼,因而Na可以从CuCl2溶液中置换出Cu ⑥Na在空气中燃烧,主要产物是Na2O2
A.①③④⑤⑥ B.③④⑥ C. ③④ D.全部
20. 将4.6g金属钠分别投入到 ①100g溶质的质量分数为7.3%的盐酸中, ②100g溶质的质量分数为4.9%的稀硫酸中,则两者放出的氢气比较( )
A. ①的多 B. ②的多 C. 两者一样多 D. 不一定
 第Ⅱ卷 非选择题(共40分) 第Ⅱ卷 非选择题(共40分)
二、填空题(本题共4小题,共32分)
21.(6分)将HCl、H2SO4、Ba(NO3)2三种溶液,按一定顺序滴入到碳酸钠溶液中至恰好完全反应,有以下现象:
①:加入A时有白色沉淀。
②:往①中的沉淀加入B时沉淀溶解,并有气体产生。
③:往②中的溶液中加入C时,又有白色沉淀生成。
(1)根据以上现象判断:(填化学式)A B
 (2)写出③中生成沉淀的离子方程式: (2)写出③中生成沉淀的离子方程式:
22.(4分)用脱脂棉花包住约0.2克过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察脱脂棉剧烈燃烧起来。
由实验现象得出的有关过氧化钠和水反应的结论是:
(1)a:有氧气生成
b: 。
(2)写出过氧化钠和水反应的化学方程式并标明电子转移个数和方向:
23.(12分)A、B、C、D、E分别是五种含有同一种金属元素的化合物,甲、乙、丙是非金属单质或氧化物,且A是一种淡黄色的固体,D的焰色反应呈黄色,它们之间的相互转化关系如下图所示:
试回答下列问题:
(1)写出下列物质的化学式:B D E 乙
(2)请写出化合物C、D间相互转化时发生反应的化学方程式:
C→D
D→C
24.(10分)某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
 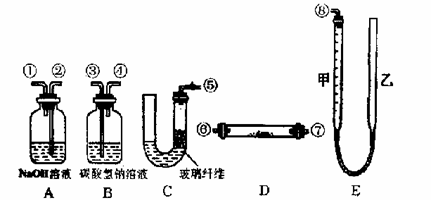
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0 — 50 mL),供量气用;乙管可上下移动,以调节液面高低,C装置可作启普发生器使用。上述装置的连接顺序是(各接口的编号,其中连接胶管及夹持装置均省略):
⑤③④⑥⑦②①⑧(⑥⑦顺序可对调) 。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试回答:
(1) 装置C中放入的反应物是 和 。
(2) 装置B的作用是 。
装置A的作用是 。
(3) 为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意视线与液面最低处相平和
(填写字母编号)
a. 读数时不一定使甲、乙两管液面相平
b. 读数时应上下移动乙管,使甲、乙两管液面相平
三、计算题(8分)
25.(8分) 取NaHCO3和Na2CO3混合粉末5.26 g,将其加热至质量不再改变,残余固体的质量为3.71 g。求该混合物中NaHCO3和Na2CO3的质量。
遂平二高2006-2007学年高一年级上学期期中考试
化学试题参考答案及评分标准
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个正确答案)
1A 2B 3A 4B 5A 6D 7D 8C 9A 10D
11B 12B 13C 14C 15A 16C 17D 18A 19B 20C
二、填空题(本题共4小题,共32分)
21. (6分) (1) A. Ba(NO3)2 B. HCl (各2分)
(2)SO42- Ba2 = BaSO4↓ (2分)
22. (4分) (1)该反应是放热反应 (2分)
 (2)2Na2O2 2H2O = 4NaOH O2↑ (2分) (2)2Na2O2 2H2O = 4NaOH O2↑ (2分)
23. (12分) (1)Na2O、NaHCO3、NaOH、H2O (各2分)
(2)Na2CO3 CO2 H2O = 2NaHCO3 (2分)
NaHCO3 NaOH = Na2CO3 H2O (2分)
24. (10分) (1) 大理石;盐酸 (各2分)
(2) 吸收混在O2中未反应的CO2; 吸收CO2中混有的HCl (各2分)
(3) b (2分)
三、计算题(8分)
25. (8分) 设NaHCO3的质量为x,
2NaHCO3  Na2CO3 + CO2 + H2O Dm (2分) Na2CO3 + CO2 + H2O Dm (2分)
84×2 18 44 62
x 5.26 g-3.71 g=1.55 g (2分)
m(NaHCO3)=x= 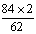 ×1.55 g=4.2 g, (2分) ×1.55 g=4.2 g, (2分)
m(Na2CO3)=5.26 g-4.2 g=1.06 g。 (2分)
|