|
一、原理部分
1、SO42-检验的原理:
Ba2 SO42-=BaSO4↓(白色)不溶解于HCl和HNO3溶液。
2、杂质干扰原理:
常见杂质有CO32-、SO32-、Ag 等离子。
= 1 \* GB3 ①CO32- Ba2 =BaCO3↓(白色)溶解于HCl和HNO3溶液。离子方程式是:
BaCO3 2H =Ba2 H2O CO2↑
= 2 \* GB3 ②SO32- Ba2 =BaSO3↓(白色)溶解于HCl溶液。离子方程式是:
BaSO3 2H =Ba2 H2O SO2↑
因HNO3溶液有强氧化性,能把BaSO3转化为BaSO4,都是白色沉淀。
= 3 \* GB3 ③Ag Cl-=AgCl↓(白色)不溶解于HCl和HNO3溶液。Ag 和SO42-不能大量共存。
3、正确检验方法是:
先加入HCl溶液,酸化待检溶液排除CO32-、SO32-、Ag 等离子。然后加入BaCl2或Ba(NO3)2溶液,如果有沉淀生成就说明有SO42-存在。
二、变化部分
①、不分步加溶液,而是加HCl和BaCl2混合溶液于待检液中,如果产生白色的沉淀,是否说明待检溶液中一定有SO42-离子存在?
答:否,因有Ag Cl-=AgCl↓(白色)不溶解于HCl溶液。干扰离子是Ag 。
②、先加HNO3溶液酸化,后加Ba(NO3)2溶液,产生白色的沉淀,是否说明待检溶液中一定有SO42-离子存在?
答:因有
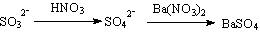
白色的沉淀可能是SO32-转化,干扰离子是SO32-。
③、先加Ba(NO3)2溶液,产生白色的沉淀,后加HNO3溶液酸化,白色的沉淀不溶解。是否说明待检溶液中一定有SO42-离子存在?
答:因有
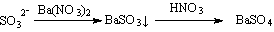
白色的沉淀可能是SO32-转化,干扰离子是SO32-。
④、先加Ba(NO3)2溶液,产生白色的沉淀,后加HCl溶液酸化,白色的沉淀不溶解。是否说明待检溶液中一定有SO42-离子存在?
答:和③比较:④中虽然加的是HCl溶液,但事前引入NO3-离子,在酸性环境下NO3-离子具有强氧化性。实际就是HNO3。故也有下列转化
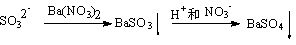
干扰离子是SO32-。
⑤、向待测液中加HCl和Ba(NO3)2混合溶液,产生不溶解的白色沉淀,是否说明待检溶液中一定有SO42-离子存在?
答:因有Ag Cl-=AgCl↓(白色)不溶解于HCl溶液。干扰离子是Ag 。
另有
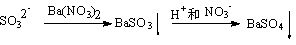
干扰离子是SO32-。
⑥、先加BaCl2溶液,产生白色的沉淀,后加HCl溶液酸化,白色的沉淀不溶解。是否说明待检溶液中一定有SO42-离子存在?
答:因有Ag Cl-=AgCl↓(白色)不溶解于HCl溶液。干扰离子是Ag 。
三、归纳总结
做SO42-检验有关题目,在理解科学检验方法的基础上,进行多方面的思考就能得到正确结论。养成多思习惯是学好化学重要性之一。
|