|
《氧族元素、环境保护》单元检测题
总分100分
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1、冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3→ClO+O2,ClO+O→Cl+O2。下列说法不正确的是
A.反应过程中将O3转变为O2
B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂
D.Cl原子反复起分解O3的作用
2、下列物质不能使品红溶液褪色的是
A.SO2 B.Cl2
C.O3 D.CO2
3、下列物质不属于“城市空气质量日报”报道的是
A.二氧化硫 B.氮氧化物
C.二氧化碳 D.悬浮颗粒
4、向50 mL 18 mol·L-1H2SO4溶液中加入足量的铜片加热。充分反应后,被还原的H2SO4的物质的量
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol
5、下列情况可能引起水污染的是
①农业生产中农药、化肥使用不当;
②生活中大量使用含磷洗涤剂;
③工业生产中废气、废液、废渣排放不当;
④生活污水的任意排放;
⑤石油运输过程中因泄漏流入江河;
⑥原子核反应的残留物随意排放。
A.①③⑤⑥ B.①③④⑤
C.①②③⑥ D.全部都是
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意)
6、按下述实验方法制备气体,合理又实用的是
A.锌粒与稀HNO3反应制备H2
B.向饱和NaCl溶液中滴加浓H2SO4制备HCl
C.亚硫酸钠与浓H2SO4反应制备SO2
D.大理石与浓H2SO4反应制备CO2
7、0.05 mol某单质与0.8g硫在一定条件下完全反应,该单质可能是
A.H2 B.O2
C.K D.Zn
8、下列反应中,调节反应物用量或浓度不会改变反应产物的是
A.H2S在氧气中燃烧 B.铁在硫蒸气中燃烧
C.SO2通入石灰水 D.H2SO4中加入锌粉
9、将含有a mol Na2SO3溶液跟含有b mol Na2S的溶液混合后无明显现象。若再加入稀H2SO4,则立即出现浅黄白色硫沉淀。有关叙述不正确的是
A.若a:b>1:2,生成S和SO2
B.若a:b=1:2,生成S而无SO2
C.若a:b<1:2,生成S和H2S
D.若a:b≤1:3,生成S、SO2、H2S
10、在烧瓶中将一卤化物与浓H2SO4的混合物共热制卤化氢气体,该卤化物是
A.CaF2 B.NaCl
C.KBr D.KI
11、为方便某些化学计算,有人将98%浓硫酸表示下列形式,其中合理的是
A.H2SO4·1/9H2O B.H2SO4·H2O
C.H2SO4·SO3 D.SO3·10/9H2O
12、有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定是BaSO4
D.此实验不能确定Na2SO3是否部分被氧化
13、对下列事实解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不反应
D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
三、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
14、某温度时CuSO4的溶解度是25g,若温度不变,将32g无水CuSO4粉末撒入m g水中,形成饱和溶液并有CuSO4·5H2O晶体析出时,m的取值范围是
A.18g≤m≤128g B.36g<m<180g
C.18g<m<128g D.36g≤m≤180g
15、常温时,向20L真空容器通入a mol硫化氢和b mol二氧化硫(a和b都是正整数,且a≤5,b≤5)反应完全后,容器内可能达到的最大密度约是
A.24.5g·L-1 B.14.4g·L-1
C.8g·L-1 D.5.1g·L-1
16、高温下硫酸亚铁发生如下反应:2FeSO4  Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
17、你认为减少酸雨产生的途径可采取的措施是
①用煤作燃料
②把工厂烟囱造高
③燃料脱硫
④在已酸化的土壤中加石灰
⑤开发新能源
A.①②③ B.②③④⑤
C.③⑤ D.①③④⑤
18、将SO2和Cl2按1:2体积比(同温同压)混合物,通入含有BaCl2和品红的混合溶液中,下列说法正确的是
A.溶液褪色,无沉淀生成
B.溶液褪色,有沉淀生成
C.溶液不褪色,无沉淀生成
D.溶液不褪色,有沉淀生成
第Ⅱ卷(非选择题,共51分)
四、填空题(本题包括4小题,共26分)
19、(6分)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式是
_____________________。
利用铜制备CuSO4的另一种方法,用化学方程式表示是______________。
以上两种方法(前、后)_______者好,原因是_____________________。
20、(8分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。
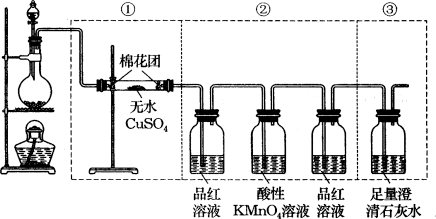
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是_______,不能检出的物质是________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____,不能检出的物质是_________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是______,不能检出的物质是_________。
五、综合题(本题包括4小题,共26分)
21、(9分)有a、b、c、d四种无色溶液,它们是Na2CO3、Na2SO4、NaHSO4、BaCl2中的某一种,为确定各是何种溶液进行了下面的实验,记录为:
①a+d→溶液+气体; ②b+c→溶液+沉淀; ③b+d→溶液+沉淀x;
④a+b→溶液y+沉淀; ⑤沉淀x+溶液y→溶液+气体。
(1)根据以上记录确定四种溶液中的溶质:
a_________;b_________;c_________;d_________。
(2)写出1—⑤各反应的离子方程式。
22、(6分)某亚硫酸钠已部分被氧化。为确定它的纯度,要进行如下实验:
①称取样品W1g;②将样品溶解;③给溶液加入稍过量盐酸酸化了的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2g。试回答:
(1)BaCl2要用盐酸酸化的原因是______________。
(2)BaCl2溶液要稍过量的原因是______________。
(3)判断操作③是否完成的方法是_____________。
(4)判断沉淀是否洗净的方法是_______________。
(5)Na2SO3纯度的表示式为___________________。
23、(6分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化剂转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式____________________。
(2)“催化剂转换器”的缺点是在一定程度上提高空气的酸度。其原因是_______________________。
(3)控制城市污染源的方法可以有____________(多选扣分)。
a、开发氢能源 b、使用电动车
c、植树造林 d、戴上呼吸面具
24、(5分)某无色溶液可能含有下列钠盐中的几种:A、氯化钠;B、硫化钠;C、亚硫酸钠;D、硫代硫酸钠;E、硫酸钠;F、碳酸钠。向此溶液中加入适量稀H2SO4,有浅黄色沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题。
(1)不能使品红试液褪色,说明该气体不含_________(填分子式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)。第一种情况____________,第二种情况____________,第三种情况______________,第四种情况__________(可不填满,也可补充)。
六、计算题(本题包括2小题,共11分)
25、(5分)某工厂每天烧掉100t含硫0.96%的烟煤,为防止SO2污染环境,用生石灰吸收SO2,最终转化为石膏(CaSO4·2H2O)。试计算理论上每年(365天)可生成石膏多少吨?
26、(6分)两分不同浓度的NaOH溶液各500mL,分别吸收1120mL(标准状况下体积)SO2气体,反应后溶液中分别有5.75g和7.10g溶质。求两份NaOH溶液的物质的量浓度。
答案:
1. C
2. D
3. C
4. A
5. D
6. C
7. C
8. B
9.D
提示:
2Na2S+Na2SO3+3H2SO4=3S↓+3Na2SO4+3H2O
A.a:b>1:2时,Na2SO3过量,故生成S和SO2
B.a:b=1:2时,Na2S与Na2SO3恰好反应
C.a:b<1:2时,Na2S过量,故生成S和H2S
D.a:b≤1:3时,Na2S过量,故生成S、H2S
10. 答案:B
浓H2SO4有强氧化性,故KBr和KI不能和浓H2SO4共热制卤代氢。CaF2可以和浓H2SO4共热制HF,但HF会腐蚀玻璃。
11. 答案:AD
设有100g溶液,则H2SO4有98g即1 mol,H2O有2g即1/9 mol。
12.CD
13.C
14 答案:C
32g无水CuSO4配成饱和溶液时需128g水,而形成CuSO4·5H2O时需18g水。
15 答案:B
a=1,b=5时,容器内所剩气体质量最大,密度最大。
16. 答案:D
SO2与BaCl2不发生的反应。SO3可与BaCl2反应,反应方程式为:SO3+BaCl2+H2O=BaSO4↓+2HCl
17. C
18 答案:B
Cl2+SO2+2H2O=H2SO4+2HCl,Cl2过量,可使品红褪色,有H2SO4生成,故加BaCl2有白色沉淀BaSO4生成。
19
答案: 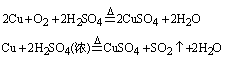
前;耗H2SO4少,且生成物对环境无污染。
20. 答案:
(1)SO2和CO2;H2O
(2)H2O;SO2和CO2
(3)SO2和CO2;H2O
21. 答案:
(1)NaHSO4;BaCl2;Na2SO4;Na2CO3
(2)①2H++CO32-=CO2↑+H2O
②Ba2++SO42-=BaSO4↓
③Ba2++CO32-=BaCO3↓
④Ba2++SO42-=BaSO4↓
⑤BaCO3+2H+=Ba2++CO2↑+H2O
22. 答案:
(1)防止BaSO3生成
(2)使SO42-完全转化为BaSO4
(3)取上层清液少许,滴加稀H2SO4,若有白色沉淀生成,则操作③完成;无沉淀,则操作③未完成。
(4)取少许洗涤液,滴加AgNO3溶液,若无沉淀,已洗净;反之,未洗净。
(5) 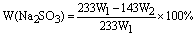
23.
答案:
(1) 
(2)SO2转化为SO3,产生硫酸酸雾
(3)ab
24. 答案:(1)SO2
(2)BDF , BCF
提示:有关反应方程式为:
Na2CO3+H2SO4=Na2SO4+CO2↑ H2O
Na2S+H2SO4=Na2SO4+H2S↑
2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O
2Na2S+Na2S2O3+3H2SO4=3Na2SO4+4S↓+3H2O
25. 答案:1883.4吨
解析:设每年可生成石膏x吨,则由硫元素质量守律可得:
S ~ CaSO4·2H2O
32 172
100t×0.96%×365 x
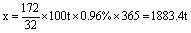 。 。
26. 答案:0.150mol/L 0.240mol/L
解析:SO2与NaOH作用可能的反应有
SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3。
1120mLSO2气体可生成0.0500 mol Na2SO3或NaHSO3,
质量是6.30g或5.20g。依题意,两份溶液中,
含溶质5.75g的一定含Na2SO3和NaHSO3;含溶质7.10g的一定含Na2SO3和NaOH。
设第一份溶液中含Na2SO3物质的量为x,NaHSO3物质的量为y,则:
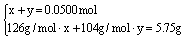
解得x=0.0250 mol,y=0.0250 mol。
原溶液中含NaOH物质的量为:
2x+y=0.0750 mol,
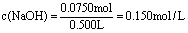 。 。
依上分析,第二份溶液中含Na2SO3 0.0500 mol,质量是6.30g,
则含NaOH的质量为:m(NaOH)=7.10g-6.30g=0.80g。
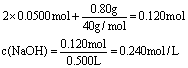
|