|
氧族元素
Ⅰ 学习重点
1.掌握氧族元素的原子结构与其单质和化合物性质递变的关系.
2.掌握臭氧的物理性质、化学性质及臭氧层的保护.
3.掌握同素异形体的概念.
Ⅱ 学习难点
氧族元素性质递变规律及其与原子结构的关系.
一、选择题
1.随着核电荷数的增加,氧族元素的性质变化规律中,正确的是( )
A.单质的熔沸点依次升高 B.单质的密度逐渐增大
C.单质都是非金属,故都不能导电 D.它们的离子半径比相应原子半径小
2.下列气态氢化物中,最不稳定的是( )
A.H2O B.H2S C.H2Se D.H2Te
3.下列物质中,酸性最强的是( )
A.H2TeO4 B.H2TeO3 C.H2SO4 D.H2SO3
4.下列关于氧族元素(除钋外)的说法中正确的是( )
A.它们的最高价均为 6价
B.它们都能跟氢气直接化合生成气态氢化物
C.它们都能形成二氧化物和三氧化物
D.它们跟大多数金属都能直接化合
5.硫的非金属性比氧弱,但从以下的事实不能做出判断的是( )
A.硫化氢不如水稳定
B.硫跟氢气反应需要加热,而氧气跟氢气反应只需点燃
C.硫化氢的水溶液露置在空气中变浑浊
D.硫是固体,氧气在常温下是气体
6.下列叙述中错误的是( )
A.实验室可用浓H2SO4跟金属硒化物反应制取H2Se
B.H2SeO3中的Se,既具有氧化性,又具有还原性
C.硒酸钠的化学式为Na2SeO4
D.碲跟氢气化合比碘跟氢气化合更困难
7.钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能具有的性质是( )
A.钋是能导电的固体 B.钋的氧化物的水化物至少有两种
C.钋与氢气不能直接化合 D.钋的氢化物很稳定
8.H2S通入H2SeO3,溶液中所得氧化产物是( )
A.S B.Se C.S和Se D.不能反应,无氧化产物
9.能使溴水、酸性KMnO4溶液褪色的一组物质是( )
A.CO、H2、SO2、H2S B.H2S、SO2、H2Se、SeO2
C.CO、SO3、HCl、H2Se D.H2Se、SeO2、H2、HI
 10.工业上从含硒的废料中提取硒的方法之一是用硫酸和硝酸钠处理废料,获得亚硒酸和少 量硒酸,再与盐酸共热,硒酸被转化为亚硒酸(2HCl H2SeO4 H2SeO3 Cl2 H2O).通SO2于亚硒酸的溶液中,单质硒即析出.据此,下列叙述正确的是( ) 10.工业上从含硒的废料中提取硒的方法之一是用硫酸和硝酸钠处理废料,获得亚硒酸和少 量硒酸,再与盐酸共热,硒酸被转化为亚硒酸(2HCl H2SeO4 H2SeO3 Cl2 H2O).通SO2于亚硒酸的溶液中,单质硒即析出.据此,下列叙述正确的是( )
A.H2SeO4氧化性弱于Cl2 B.亚硒酸氧化性强于H2SO3
C.SeO2的还原性强于SO2 D.析出1molSe,需H2SeO3、SO2、H2O各1mol
二、填空题
  11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染会破坏臭氧层,如超音速飞机排放物中的氮氧化 物(NO和NO2),它们和O3及O发生如下反应:O3 NO NO2 O2,O NO2 NO O2,这两个反应反复循环,其总反应式为 ,由 此可见氮氧化物在破坏臭氧层的过程中起了 的作用. 11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染会破坏臭氧层,如超音速飞机排放物中的氮氧化 物(NO和NO2),它们和O3及O发生如下反应:O3 NO NO2 O2,O NO2 NO O2,这两个反应反复循环,其总反应式为 ,由 此可见氮氧化物在破坏臭氧层的过程中起了 的作用.
12.氧族元素包括 ,其原子结构的共同点是 ,不同点是随着核电荷数的增加,原子核外电子层数 ,原子半径 ,原子获得电子的能 ,失电子的倾向 ,因此,氧族元素的金属性 ,非金属 性 .其中阴离子还原性最弱的是 , 氢化物最稳定的是 ,最高价氧化物对应的水化物酸性最强的是 .
13.有A—F六种气体,根据下列事实,判断各是哪一种气体?并写出有关反应的化学方程式:
①D极易溶于水;
②C、D、E、F的溶液的pH值小于7
③A在C中可燃烧,产生苍白色火焰,并生成D;
④将F在B中进行充分燃烧生成E和水蒸气,E能漂白有色的潮湿花朵.
(1)写出A—F的化学式:
A ,B ,C ,D ,E ,F ;
(2)写出有关反应的化学方程式
14.现有A、B两种化合物,具有如下性质:
(1)A B H2SO4 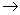 Na2SO4 S↓ H2O; Na2SO4 S↓ H2O;
(2)A H2SO4 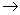 Na2SO4 G↑ H2O Na2SO4 G↑ H2O
(3)B H2SO4 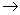 Na2SO4 E↑; Na2SO4 E↑;
(4)G E 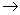 S↓ H2O; S↓ H2O;
(5)G I2 H2O 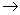 HI H2SO4. HI H2SO4.
根据以上事实推断(写化学式):A ,B , E ,G ;
写出上述有关反应的离子方程式(不是离子反应的写化学方程式):
(1) ;(2) ;(3) ;
(4) ;(5) .
第六章 硫和硫的化合物 环境保护
第一节 氧族元素参考答案
一、1.AB 2.D 3.C 4.AD 5.D 6.A 7.D 8.A 9.B 10.B
 二、11.O3 O 2O2 催化 二、11.O3 O 2O2 催化
12.O、S、Se、Te、Po,原子最外层电子数都有6个、增多、增大、减弱、增 强,逐渐增强逐渐减弱,O2-,H2O,H2SO4
13.(1)H2、O2、Cl2、HCl、SO2、H2S
点燃 点燃
  (2)H2 Cl2 2HCl2 H2S 3O2 2SO2 2H2O (2)H2 Cl2 2HCl2 H2S 3O2 2SO2 2H2O
14.Na2SO3、Na2S、H2S、SO2
 (1)SO32 2S2- 6H 3S↓ 3HCO (1)SO32 2S2- 6H 3S↓ 3HCO
 (2)SO32- 2H SO2↑ H2O (2)SO32- 2H SO2↑ H2O
 (3)S2- 2H H2S↑ (3)S2- 2H H2S↑
 (4)SO2 2H2S 3S 2HCO (4)SO2 2H2S 3S 2HCO
 (5)SO2 2H2O I2 SO42- 4H 2I- (5)SO2 2H2O I2 SO42- 4H 2I-
|