|
硫和硫的化合物练习题(B)
班级 学号 姓名
一. 选择题
[ ]1.某盐a和某酸b反应,得到刺激性气味气体c,c与烧碱反应可生成a,c可被氧化成气体d,d和烧碱溶液反应生成物中也有a. 则a,b分别是
A.KMnO4和浓HCl B.Na2SO3和浓H2SO4
C.Na2S和盐酸 D.NaCl和浓H2SO4
[ ] 2.以下有关接触法制硫酸的论述错误的是
A.为提高反应速度和原料利用率,硫铁矿要在“沸腾”状态下燃烧
B.为防止催化剂中毒,气体在进接触室前要先净化
C.接触室中热交换器其主要作用是预热末反应的气体和冷却反应后的气体
D.吸收塔中SO3从下而上,水从上而喷下,剩余气体从上部出来放空
[ ]3.下列变化的实质相似的是:
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B.SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D.HBr,HI气体不能用浓H2SO4制取.
[ ]4.下列化合物可用两种单质直接化合得到的是
A、FeS B、CuS C、FeCl2 D、H2Te E、SO3
[ ]5.下列说法中正确的是 [ ]
A.把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用.
B.氢硫酸是弱酸,不能与强酸盐生成强酸.
C.稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应.
D.硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中.
[ ]6..a克铜与足量的浓硫酸共热,完全反应产生标况下b升气体,则被还原的硫酸不可能是
A. 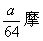 B. B. 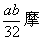 C. C. 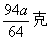 D. D. 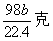
[ ]7.密度为1.45克/厘米3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀物与原溶液的质量相等,则原硫酸溶液的物质的量浓度为
A.29.6% B.42.1% C.14.8摩/升 D.6.22摩/升
[ ]8.能在空气中稳定保存的物质是
A.亚硫酸 B.亚硫酸钠 C.硒化氢水溶液 D.硫黄
[ ]9.向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0.45摩 B.等于0.45摩
C.在0.45摩与0.90摩之间 D.大于0.90摩
[ ]10.向三氯化铁和氯化钡的混和溶液中通入二氧化硫气体,有白色沉淀生成,此沉淀是
A.硫化亚铁 B.硫磺 C.亚硫酸钡 D.硫酸钡
11.石膏[CaSO4·2H2O]加热到150~170℃时,会失去部分结晶水而生成熟石膏[2CaSO4·H2O],则通过加热每生成1摩熟石膏失去水的物质的量为
A.1摩 B.1.5摩 C.2摩 D.3摩
12.下列反应产生的气体,通过Na2SO3溶液而不反应的是
① Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④浓硝酸和铜片
⑤铜片和浓硫酸共热 ⑥固体NaCl和浓H2SO4 ⑦FeS和稀硝酸
A.①② B.② C.①②⑤ D.全部反应
13、在下列反应中,硫酸不作氧化剂的是:
A、2KMnO4 5H2S 3H2SO4 = K2SO4 2MnSO4 5S↓ 8H2O
B、 2HBr H2SO4(浓)====Br2 SO2↑ 2H2O
C、 Zn H2SO4=ZnSO4 H2↑
D、2NaNO3 2H2SO4(稀) Cu= Na2SO4 CuSO4 2NO2↑ 2H2O
14.在氯化钡溶液中通入SO2 ,溶液仍澄清,若将氯化钡溶液分装两只试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2 ,结果两试管中都有白色沉淀生成.由此得出下列结论合理的是
A.氯化钡有两性
B.两支试管中的白色沉淀都是BaSO4
C.SO2 具有还原性和酸性
D.升高PH值使SO2 水溶液中SO3 2- 浓度增大
15、下列实验能证明有SO2存在的是:
①能使品红溶液褪色,
②能使湿润的蓝色石蕊试纸变红,
③能使澄清的石灰水变浑浊,
④通入足量有NaOH溶液中再滴加BaCl2溶液,有白色沉淀生成,该沉淀能溶于稀盐酸,
⑤通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀。其中正确的是:
A、都能证明 B、都不能证明
C、①④⑤能证明 D、只有⑤能证明
16.在2FeS 6H2SO4(浓)Fe2(SO4)3=3SO2↑ 2S↓ 6H2O反应中,
还原剂是 ,氧化产物和还原产物的质量比为
〖提示〗:Fe2(SO4)3也是氧化产物
17.某黑色固体A与盐酸反应,生成气体B,B 与无色气体C反应生成一种不溶于水的淡黄色固体D,无色气体C能使澄清石灰水变浑浊,且能与饱和碳酸氢钠溶液反应生成无色气体E,根据以上事实:
(1)写出A、B、C、D、E五种物质的化学式
A B C D E 。
(2)写出下列反应的离子方程式
A HCl—: 。
C NaHCO3—: 。
18.三位学生设计了下述三个方案,并都认为, 如果观察到的现象和自己设计的方案一致,即可确证试液中含有硫酸根离子

  方案甲:试液 方案甲:试液  白色沉淀 沉淀不溶解 白色沉淀 沉淀不溶解
  方案乙:试液 无沉淀 白色沉淀 方案乙:试液 无沉淀 白色沉淀
  方案丙:试液 无沉淀 白色沉淀 方案丙:试液 无沉淀 白色沉淀
试评价上述各方案是否严密?并说明理由。
19.有一Na2S、Na2SO3和Na2SO4的混合物,经测定含硫25.6%,则此混合物中氧元素质量分数为 钠元素的质量分数为 。
20.A和B在常温下都是气体。A和B在空气中都不能被点燃,A的分子量比B大。现分步实验如下:在A溶液中通入适量的B气体,溶液酸性显著增强;继续加硝酸钡溶液反应得到一种不溶于稀硝酸的白色沉淀,过滤出沉淀,得无色滤液;再向滤液中加入硝酸银溶液,又析出另一白色沉淀。推断写出:
(1)A、B两种气体的名称:A B 。
(2)上面实验步骤中各步反应的化学方程式:
① 。
② 。
③ 。
21.矿物胆矾遇到黄铁矿发生反应,铜元素将以辉铜矿(Cu2S)形式沉积下来,而反应得到的硫和铁则进入水溶液。该溶液无臭味,透明不浑浊,绿色,呈强酸性,在有的矿区可见到这种具有强腐蚀性的地下水(俗称黑水)渗出地面,上述反应可以用一个化学反应方程式表示,试写出配平的化学方程式:
22.某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A、B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:
Cl2 Na2SO3 H2O == Na2SO4 2HCl
试写出:
(1)A、B处应加入的物质的化学式依次为
(2) A、B处发生的反应的离子方程式是:
23.工业上制取CuSO4不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡,试分析这种制备办法的优点。
24. 某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式 。
(2)现用1㎏这种废铜屑理论上能制取胆矾多少千克?
(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂
波尔多液
① 此波尔多液中Cu2 离子和Ca2 离子的物质的量比为 (最简整数比)。
② 波尔多液有效成分的化学式可表示为CuSO4·χCu(OH)2·уCa(OH)2,
此种配比当χ=1时,试确定у的数值。
25.某金属的可溶性硫酸盐和碳酸盐2.48g,与过量氯化钡溶液反应,生成4.3g沉淀,将沉淀洗净后,放入过量稀硫酸中,除有无色气体产生外,发现沉淀质量增至4.66g.试求该金属的相对原子质量.
【参考答案】
1、D 2、 D 3、 D 4、A 5、D 6、BC 7、D 8、D 9、A 10、D
11、D 12、B 13、AD 14、C D 15、D
16、【答:FeS】 【答:29:12】
17、(1)FeS、H2S、SO2、S、CO2(2)FeS 2H =Fe2 H2S↑、
SO2 HCO3-= HSO3- CO2
18、方案乙是严密的
19、37.6%、36.8%
20、Cl2、SO2、①Cl2 SO2 2H2O=2HCl H2SO4
②H2SO4 Ba(NO3)2=BaSO4↓ 2HNO3
③HCl AgNO3=AgCl↓ HNO3
21、14CuSO4 5FeS2 12H2O=7Cu2S 12H2SO4 5FeSO4
22、【答:Na2SO3】和【答:NaOH】
A【答:Cl2 SO32- H2O == SO42- 2H 2Cl-】
B【答:H OH- == H2O】
23、〖提示:这种办法的优点主要有两处:一是不产生污染空气的二氧化硫,二是提高了硫酸的利用率〗
24、 (1)2Cu O2 2H2SO4→2CuSO4 2H2O
(2) 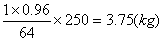
(3) ①  2 : 5 2 : 5
25、23(Na)
|