| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
A.仅②③④ B.仅①③④ C.仅①②③④ D.①②③④⑤ 15. 在浓盐酸中HNO2与SnCl2反应的离子方程式为: 3SnCl2 12C1- 2HNO2 6H =N2 3SnClxy- 4H2O。关于该反应的说法错误的是 A.氧化剂是HNO2 B.还原性:Cl一>N2 C.每生成2.8gN2,还原剂失去的电子为0.6mol D.SnClxy-是氧化产物。 16. 向某NaOH溶液中通人CO2气体后得溶液M,因C O2通入量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2) 与加入盐酸的体积V(盐酸)的关系如下图所示,则下列分析与判断不正确的是(不计CO2的溶解)
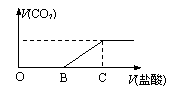 A.若OB=0,则形成溶液M所发生的离子反应方程式为: A.若OB=0,则形成溶液M所发生的离子反应方程式为:
OH一 CO2=HCO3一 B.若OB=BC,则溶液M为Na2CO3溶液 C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3一 D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
第Ⅱ卷 (非选择题 共60分) 17. (19分) A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大。元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多l,B、C、F的质子数之和等于E、G的质子数之和。 请回答下列问题: (1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式___________________(至少写出四种)。 (2)写出BC2的结构式:_____;它是______ (填“极性”或“非极性”)分子。 (3)用电子式表示C、D两种元素形成化合物D2C的过程_______________________________。 (4)由A、C、F三种元素中的一种或两种可分别形成甲、乙两种粒子,它们均是-2价的阴离子,且甲为四核42电子的微粒,乙为单核18电子的微粒,则甲与乙在酸性条件下反应的离子方程式为:________________________________________________。 (5)D、E二种元素的原子都能形成相应的离子,则两离子半径大小关系为_________________(用离子符号表示);将D、E二种元素的单质同时放入水中,充分反应后,测得溶液中只有一种溶质,且无固体物质剩余,则所放入水中D的单质和E的单质的质量之比为____________________, 若D的单质的物质的量为amol,则上述反应中生成单质总的物质的量为________________。 (6) FC2与含0.5 molG的一种含氧酸(该酸的某盐在有催化剂存在的条件下常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有3.01×1023个电子转移,则该反应的化学方程式是______________________________________。
(1)请写出一个含有A、B两种单质的置换反应:__________________________。 (2) H转化为D的反应是某种工业的主要反应之一,请写出此反应的化学方程式: _______________________________________________________。 (3)反应⑤的离子方程式为 。
19.(7分) 有一无色透明溶液,欲确定是否含有下列离子:K 、Mg2 、Al3 、Fe2 、Ba2 、NO3—、SO42—、Cl—、I—、HCO3—,取该溶液实验如下:
| 实验步骤
| 实验现象
| ①取少量该溶液,加入几滴石蕊试液
| 溶液变红色
| ②取少量该溶液加热浓缩,加入Cu片和浓H2SO4,并加热
| 有无色气体产生,气体遇空气变成红棕色
| ③取少量该溶液,加入BaCl2溶液
| 有白色沉淀生成
| ④取③中上层清液,加入AgNO3溶液
| 有稳定的白色沉淀生成,且不溶于HNO3
| ⑤取少量该溶液,加入NaOH溶液
| 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是___________,溶液中肯定不存在的离子是_______________。
(2)为进一步确定其它阳离子,应该补充的实验为____________________。
20.(15分) 某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计 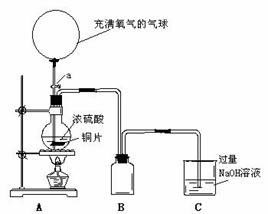 了下图所示装置进行有关实验:
了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
______________________,_____________________。
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在图上把导管补充完整。
③实验结束后,装置C的溶液中溶质可能有________;
(2)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定余酸的物质的量浓度,甲、乙、丙、丁四位同学进行了如下设计:
在挤入O2之前,先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他们认为测定SO2的量的方法有多种,下列实验方案中可行的是_______________(填写编号)。
甲:将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
乙:将装置A产生的气体缓缓通入足量用硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
丙:用排水法测定装置A产生气体的体积(已折算成标准状况)
丁:用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
21. (10分) 将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应。在反应的溶液中加
入足量石灰水,得到m g沉淀。
(1)能否用上述数据确定参加反应的CO2的体积(标准状况)?________(“能”或“不能”),若能,列式表示为__________________________。若不能,理由是____________________。
(2)能否用以上数据确定NaOH溶液的物质的量浓度?_____________(“能”或“不能”)。若在上述CO2和NaOH反应后的溶液不加入石灰水而是加入足量CaCl2溶液,结果得到了沉淀n g。设原NaOH溶液的物质的量浓度为c,则:
①当n=m时,c=______________________________;
②当n=0时,c=_______________________________;
③当n<m时,c=______________________________。
湖北省天门中学高一2009年元月考试
化学试题参考答案及评分标准
单选题(3分×16=48分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
C
D
D
C
C
D
A
C
A
B
B
A
C
B
C
非选择题(共60分)
17.(19分)
(1)SO2、H2SO3、H2O2、Na2O2、HClO、NaClO中的四种(4分);
(2)O=C=O(1分) 非极性(1分)
(3) ![]() (3分)
(3分)
(4) SO32- 2S2- 6H =3S↓ 3H2O(3分)
(5)r(Na )> r(Al3 )(1分) 23∶27(1分) 2amol(2分)
(6)SO2+2HClO3=H2SO4+2ClO2 (3分)
18.(9分)
(1)SiO2+2C高温Si+2CO↑ (3分)
(2)SiO2+Na2CO2高温Na2SiO3+CO2↑ (3分)
(3)SO2+Br2+2H2O 4H++SO42-+2Br- (3分)
19.(7分)
(1) Mg2 、Al3 、NO3—、SO42—(3分) Fe2 、Ba2 、I—、HCO3—(3分)
(2)焰色反应(1分)
20.(15分)
(1)①Cu 2H2SO4(浓) ![]() CuSO4 SO2↑ 2H2O(3分)
CuSO4 SO2↑ 2H2O(3分)
2Cu+2H2SO4+O2=2CuSO4+2H2O(3分)
②B装置中导气管长进短出(3分)
③Na2SO3、Na2SO4、NaOH(3分)
(2)丁(3分)
21.(10分)
(1)能(1分) V(CO2)=22.4m/100 L(2分)
(2)不能(1分)
①m/(50v)mol/L或n/(50v)mol/L(2分)
②m/(100v)mol/L(2分)
③(m+n)/(100v)mol/L(2分)
| |