| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
【基础知识精讲】 一、物质的量(n) 物质的量是国际单位制中七个基本物理量之一,1mol任何粒子都含有阿伏加德罗常数个粒子.1mol任何物质的质量在数值上等于该物质的相对分子质量。物质的量的单位是“摩尔”,“摩”符号为“mol”.
二、阿伏加德罗常数(NA) 以0.012kg12C所含的碳原子数作基准,其近似值为6.02×1023mol-1.
三、物质的量与粒子数的关系 N=n·NA 满足上述关系的粒子是构成物质的基本粒子(如分子、原子、离子、质子、中子、电子数)或它们的特定组合. 如:1molCaCl2与阿伏加德罗常数相等的粒子是CaCl2粒子,其中Ca2 为1mol、Cl-为2mol,阴阳离子之和为3mol或原子数为3mol. 在使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称。例如说“1mol氧”,是指1mol氧原子,还是指1mol氧分子,含义就不明确。又如说“1mol碳原子”,是指1mol12C,还是指1mol13C,含义也不明确。 粒子集体中可以是原子、分子,也可以是离子、电子等。例如:1molF,0.5molCO2,1000molCO32-,amole-,1.5molNa2CO3·10H2O等。 1molF中约含6.02×1023个F原子; 0.5molCO2中约含0.5×6.02×1023个CO2分子; 1kmolCO32-中约含1000×6.02×1023个CO32-离子; amole-中约含a×6.02×1023个e-; 1.5molNa2CO3·10H2O中约含1.5×6.02×1023个Na2CO3·10H2O,即约含有3×6.02×1023个Na 、1.5×6.02×1023个CO32-、15×6.02×1023个H2O.
四、摩尔质量(m) 单位 g·mol-1 1.定义:单位物质的量的物质所具有的质量叫摩尔质量,即1mol该物质所具有的质量与摩尔质量的数值等同. 2.1mol粒子的质量以克为单位时在数值上都与该粒子的相对原子质量(Ar)或相对分子质量(Mr)相等.
五、几个基本符号 物质的量——n 物质的质量——m 摩尔质量——M 粒子数——N 阿伏加德罗常数——NA 相对原子质量——Ar 相对分子质量——Mr 质量分数——W
六、物质的量、质量、及粒子数转换关系
七、注意几点: 1.物质的量与摩尔的区别和联系
|
| 物质的量
| 摩尔
| 区别
| 表示含有一定数目粒子的集体的物理量
| 为物质的量的单位
| 联系
| 摩尔是物质的量的单位 | ||||||
2.物质的量与阿伏加德罗常数的区别和联系
物质的量
阿伏加德罗常数
区别
表示物质所含数目的集体的物理量、单位是摩尔
0.012kg12C所含碳原子数,单位mol-1
联系
![]()
【重点难点解析】
1.本节涉及的新概念很多,理论性强,也比较抽象,对概念的准确理解,过好概念关,是学习本节的关键.
2.对于容易混淆的概念,如物质的量与摩尔,质量与摩尔质量,摩尔质量与相对分子质量、相对原子质量等,要通过对比,找出它们的区别与联系.
3.采用类比的方法,可以使概念通俗易懂,便于理解和记忆.
例1 下列说法正确的是( )
A.1mol氯含有6.02×1023个微粒 B.阿伏加德罗常数数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量 D.H2O的摩尔质量是18g
解析:A错误在于使用摩尔时没有指明微粒的名称,或为1mol氯气约含6.02×1023个氯气分子,或为1mol氯原子约含6.02×1023个氯原子.
B正确.
C错在把摩尔质量与相对原子质量混同,应为钠的摩尔质量在数值上等于它的相对原子质量.
D错在摩尔质量的单位,应为H2O的摩尔质量是18g/mol,故选B.
答案:B
例2 ①2gH2 ②2molNH3 ③9gH2O ④含1.505×1023个H2SO4分子的硫酸,所含原子数由少至多的顺序是
解析:比较所含原子数多少,只要计算出所含原子的物质的量进行比较即可.①2gH2含H原子为2mol,②2molNH3中原子为8mol,③9gH2O含原子为(9g/18g·mol-1)×3=1.5mol,④1.505×1023个H2SO4分子含原子为(1.505×1023/6.02×1023mol-1)×7=1.75mol,所以原子数由少至多顺序为:③④①②.
答案:③④①②
例3 根据反应:
Fe2O3 3CO ![]() 2F 3CO2,若有3mol电子转移,则有 mol铁生成,有 个CO分子参加反应.
2F 3CO2,若有3mol电子转移,则有 mol铁生成,有 个CO分子参加反应.
解析:本题意在以氧化还原反应为载体,考查学生灵活运用所学知识的能力.
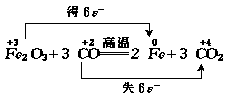
根据元素的价态变化不难看出,每生成1molFe得到了3mole-,每有1molCO参加反应失2mole-,故有3mole-转移时,有1molFe生成,消耗1.5molCO,N(CO)=n(CO)·NA=1.5mol×6.02×1023mol-1=9.03×1023
答案:1;9.03×1023
【难解巧解点拨】
例1 已知Ar(S)为32,则1个S原子的质量是 g.
分析 据Ar(S)=32,知1molS为32g,S原子数为6.02×1023个,故1个S原子的质量为 ![]() =5.32×10-23g.
=5.32×10-23g.
评析 若求每个离子的质量方法同上(因为得失电子产生的质量差可忽略)
例2 0.8g某物质含有3.01×1022个分子,该物质的相对分子的质量约为( )
A.8 B.16 C.64 D.160
解:据M= ![]() n=
n= ![]() 则M=
则M= ![]() =16g·mol-1
=16g·mol-1
故选B
例3 2.3g金属钠与水反应所得溶液中,要使每100个水分子中溶有1个Na 离子.求所需水的质量.
解:100个水分子中溶有1个Na 即1molNa 对应水的物质的量应为100mol.2.3gNa为0.1mol,变成Na 其物质的量仍为0.1mol,溶液中应有水10mol包括反应消耗掉的水,即
2Na 2H2O=2NaOH H2↑
2 2
0.1mol n(H2O)
n(H2O)=0.1mol
所以总共需H2O的质量为m(H2O)=(0.1mol 10mol)×18g·mol-1
=181.8g
例4 (1)标出Fe2O3与CO反应电子转移方向及数目.
(2)若此反应转移的电子数为a个,生成的CO2为bmol.
通过计算用ab表示阿伏加德罗常数为 .
解 (1) 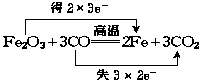
(2)由上述反应知,转移电子数为6e-时有3个CO2分子生成,电子转移数为a个时,N(CO2)= ![]() ×3=
×3= ![]()
据公式:NA= ![]() =
= ![]() =
= ![]() mol-1
mol-1
例5 在反应X 2Y=R 2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为( )
A.16∶9 B.23∶9 C.32∶9 D.46∶9
解:假设R与M的摩尔质量分别是为rg/mol和mg/mol,有r/m=22/9.又假设参加反应的Y为ag,生成M为bg。根据质量守恒定律可列出关系式:1.6 a=4.4 b,化简得a=b 2.8.
再根据方程式的比例式可得:8.8m=rb,b=3.6.
∴a/b=(b 2.8)b=(3.6 2.8)/3.6=16/9.答案为(A).
评析 “守恒法”解题是指在解题过程中利用化学反应或化学现象中的一些守恒关系来解决化学问题的一种独特的解题方法.本题依据质量守恒关系列式解题.只要“守恒法”使用得当,可收到解题步骤简捷、快速、准确之功效.
【典型热点考题】
例1 若1gN2中含有x个原子,则阿伏加德罗常数是( )
A. ![]() mol-1 B.
mol-1 B. ![]() mol-1 C.14xmol-1 D.28xmol-1
mol-1 C.14xmol-1 D.28xmol-1
解析:求阿伏加德罗常数就是利用已知条件求1molN2中含有的原子个数NA(NA是未知数),应以物质的量为“桥梁”,用NA= ![]() 求得解决.
求得解决.
因为M(N2)=28g·mol-1,所以1gN2的物质的量为:n(N2)= ![]() =
= ![]() mol
mol
n(N)=2n(N2)= ![]() mol
mol
所以NA= ![]() =
= 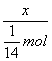 =14x·mol-1
=14x·mol-1
答案:选C.
例2 某固体仅由一种元素组成,其密度为5g/cm3.用X射线研究固体的结果表明:在棱长为1×10-7cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A.32 B.65 C.120 D.150
解析:此题意在以“物质的量”作“桥梁”,借助“摩尔质量”来“引渡”,训练学生思维的灵活性.要求该元素的相对原子质量,亦即先求1mol该原子的质量,即是求出6.02×1023个该原子的质量.依题意,20个原子的质量
m=ρV=5g/cm3×(1×10-7cm)3=5×10-21g,故1mol该原子(约为6.02×1023个)的质量约为6.02×1023×5×10-21g/20=150g,所以该元素的摩尔质量为150g/mol,此元素的相对原子质量接近于150.
答案:D.
例3 下列数量的物质中含原子个数最多的是( )
A.0.4摩尔氧气 B.3.01×1022CO2分子
C.4℃时5.4毫升水 D.10g氖
解析:分别计算各物质中所含原子的物质的量,物质的量最大的即为原子个数最多的.A中n(0)=0.4×2=0.8mol,B中n= ![]() ×3=0.15mol,C中n=
×3=0.15mol,C中n= ![]() ×3=0.9mol,D中n=
×3=0.9mol,D中n= ![]() ×1=0.5mol,故选C.
×1=0.5mol,故选C.
答案:C.
例4 与24.5gKClO3所含O原子个数相同的KMnO4的质量应是( )
A.24.5g B.47.4g C.47g D.23.7g
解析:M(KClO3)=122.5g·mol-1
n(KClO3)= ![]() =
= ![]() mol=0.2mol
mol=0.2mol
n(O)=0.2×3mol=0.6mol
n(kMnO4)= ![]() n(O)=
n(O)= ![]() ×0.6mol=0.15mol
×0.6mol=0.15mol
m(kMnO4)=M(KMnO4)·n(KMnO4)=158×0.15g=23.7g
答案:D.
例5 在反应X 2Y = R 2S中,已知R和S的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,在此反应中Y和S的质量之比为 .
解析:本题可巧妙地运用“质量守恒定律”求解.
由反应方程式:
X 2Y =R 2S
22 9×2
4.4g m(s)
![]() =
= ![]() m(s)=3.6g
m(s)=3.6g
根据质量守恒定律:
1.6g m(y)=4.4g 3.6g m(y)=6.4g
m(y):m(s)=6.4g:3.6g=16∶9
答案:16∶9
【知识验证实验】
阿伏加德罗常数的测定
实验用品:
胶头滴管、量筒(10mL)、圆形水槽(直径30cm)、直尺.
硬脂酸的苯溶液
实验目的:
学习利用单分子膜法测定阿伏加德罗常数的原理和操作方法.
实验步骤:
1.测定从胶头滴管滴出的每滴硬脂酸的苯溶液的体积.
取一尖嘴拉得较细的胶头滴管,吸入硬脂酸的苯溶液,往小量筒中滴入1mL,然后记下它的滴数,并计算出1滴硬脂酸溶液的体积V1.
2.测定水槽中水的表面积.
用直尺从三个不同方位准确量出水槽的内径,取其平均值.
3.硬脂酸单分子膜的形成.
用胶头滴管吸取硬脂酸的苯溶液(如滴管外有溶液,用滤纸擦去),在距水面约5cm处,垂直往水面上滴一滴,待苯全部挥发,硬脂酸全部扩散至看不到油珠时,再滴第二滴.如此逐滴滴下,直到滴下一滴后,硬脂酸溶液不再扩散,而呈透镜状时为止,记下所滴硬脂酸的苯溶液的滴数d.
4.把水槽中水倒掉,用清水将水槽洗刷干净后,注入半槽水,重复以上操作二次.重复操作时,先将滴管内剩余的溶液挤净,吸取新鲜溶液,以免由于滴管口的苯挥发引起溶液浓度的变化.取三次结果的平均值.
5.计算
(1)如称取硬脂酸的质量为m,配成硬脂酸的苯溶液的体积为V,那么每毫升硬脂酸的苯溶液中含硬脂酸的质量为m/V.
(2)测得每滴硬脂酸的苯溶液的体积为V1,形成单分子膜滴入硬脂酸溶液的滴数为(d-1),那么形成单分子膜需用硬脂酸的质量为:
V1(d-1)· ![]() =
= ![]()
(3)根据水槽直径,计算出水槽中水的表面积S.已知每个硬脂酸分子的截面积A=2.2×10-15cm2,在水面形成的硬脂酸的分子个数为:S/A.
(4)根据(2)和(3)的结果,可计算出每个硬脂酸分子的质量为:
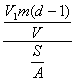 =
= ![]()
(5)1mol硬脂酸的质量等于284g(即M=284g/mol),所以1mol硬脂酸中含有硬脂酸的分子个数,即阿伏加德罗常数N为:
N= 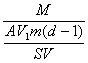 =
= ![]()
说明:计算所得N的值只要其数量级为1023均可.
【知识探究学习】
19世纪中期,某化学家为了测定元素X的摩尔质量而选择了如下的方法:他制备了含有X的四种化合物A、B、C、D,并测定了每种化合物中X的质量分数.在250℃时,四种化合物都是气态.将它们分别转移至预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压强达到1.013×105Pa,称每个烧瓶的质量,减去空瓶的质量后可得烧瓶内气体的质量.用氮气重复这一过程,得到如下数据表.
气体
气体的质量(g)
气体中X元素的质量分数(%)
A
0.849
97.4
B
2.398
68.9
C
4.851
85.1
D
3.583
92.2
N2
0.652
——
请通过计算后确定元素X的可能的摩尔质量.
答案:35.5g·mol-1
提示:只要知道1molA、B、C、D中X的质量,由其公约数,便可推知X的摩尔质量.
【生活实际运用】
在日常生活中,人们常用沼气(主要成分为甲烷CH4)和石油液化气(主要成分为丙烷C3H8)作燃料,为了使燃料充分燃烧并使能量得到充分利用,需要将燃料和空气的混合比例调整适当.现有一家庭先使用的是自制的沼气作燃料,沼气用完后改用石油液化气,那么他在使用石油液化气时对燃气灶的燃料进气阀或空气进气阀作怎样的调整?(已知CH4 2O2 ![]() CO2 2H2O,C3H8 5O2
CO2 2H2O,C3H8 5O2 ![]() 3CO2 4H2O)
3CO2 4H2O)
解析:因为1molCH4完全燃烧需要2molO2,而1molC3H8完全燃烧需要5molO2,要使燃料充分燃烧,在保持燃料进气阀不变的情况下,需要将空气进气阀开大些,以使O2充足,让燃料充分燃烧;若保持空气进气阀不变,需要将燃料进气阀适当调小.

【同步达纲练习】
一、选择题
1.下列说法正确的是( )
A.氮的相对原子质量就是一个氮原子的质量
B.一个碳原子的质量大约是1.66×10-24g
C.氢氧化钠的摩尔质量是40g
D.氩气的摩尔质量(g/mol)在数值上等于它的原子量
2.在高温下用CO还原mg氧化铁,得到ng铁,已知氧的原子量为16,则铁的原子量为( )
A.2(m-n)/3n B.24n(m-n)
C.(m-n)/8n D.n/24(m n)
3.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2L氮气含有的分子数为0.5NA.
B.在常温常压下,1mol氮气含有的原子数为NA.
C.32g氧气所含的原子数为2NA
D.相同质量的磷酸和硫酸所含的原子数目相同
4.1molMgCl2中含有( )
A.1mol氯化镁分子 B.6.02×1023个Cl-
C.2molCl- D.3×6.02×1023个电子
5.下列物质中含有的钾离子的物质的量为0.1mol的是( )
A.56gKOH B.12.25gKClO3 C.0.1molK2SO4 D.3.9g钾
6.0.1molMgCl2跟0.1molAgNO3反应生成AgCl沉淀为( )
A.0.1mol B.0.2mol C.14.3g D.28.7g
7.下列叙述中正确的是( )
A.1mol任何纯净物都含有相同的原子数
B.1molO2中约含有6.02×1023个氧分子
C.1mol氢中含有2mol氢原子,和2mol电子
D.阿伏加德罗常数就是6.02×1023mol-1
8.物质的量为a的CaCl2溶解在1molH2O中,测得溶液中Cl-与H2O分子的物质的量之比为1∶10,则a为( )
A.0.05mol B.0.1mol C.0.5mol D.10mol
9.在2KI O3 H2O=2KOH I2 O2的反应中,当有2mol的KI被氧化时,被还原的O2为( )
A.1mol B.1/2mol C.1/3mol D.2/3mol
10.能从水溶液中还原6molH 的是( )
A.2molFe B.6molOH- C.6molI- D.6molLi
11.现有A、B、C三种化合物,各取40g相混合、完全反应后的18gB、49gC还有D生成.已知D的相对分子质量为106.现将22gA和11gB反应,能生成D的物质的量为( )
A.1mol B.0.5mol C.0.275mol D.0.25mol
二、填空题
12.判断下列叙述是否正确
(1)1摩氮( )
(2)5摩原子氢( )
(3)氢氧根离子的摩尔质量是17g( )
(4)1摩氨气的质量是17g/mol( )
(5)0.1摩水分子含有6.02×1022个水分子( )
(6)1摩任何物质的质量就等于该物质的相对分子质量( )
13.0.3摩氨气和0.4摩硫化氢的质量 等,所含分子数 等,原子数 等,物质的量 等.(填相等或不相等)
14.32g氧气,8g氢气,14g氮气,它们所含分子数之比为 ,质量之比为 ,原子个数之比为 .
15.23.75g某二价金属的氯化物(MCl2)中含有3.01×1023个Cl-离子,则MCl2的摩尔质量是 ,MCl2的相对分子质量是 ,M的相对原子质量是
三、计算
16.0.5molA元素的原子被氧化为简单离子失去1mole-.0.4gA的单质与盐酸反应,生成上述A的阳离子时,可放出0.02gH2.通过计算确定A是什么元素.
【素质优化训练】
一、选择题
1.下列叙述中正确的是( )
A.39gK变成K 时失去的电子数目为NA
B.18gH2O所含电子数目为NA
C.8g氦气所含的分子数目为NA
D.2gH2所含H原子数目为NA
2.现有一真空瓶的质量为W1g,该瓶充满空气后的质量为W2g.在相同条件下改充满另一种气体x时质量为W3g.则该气体的摩尔质量为(Mr(空气)为29)( )
A. ![]() ×29g B.
×29g B. ![]() ×29g/mol
×29g/mol
C. ![]() ×29g D.
×29g D. ![]() ×29g/mol
×29g/mol
3.含氧元素质量相同的NO、NO2、N2O3、N2O5中氮原子的质量比是( )
A.1∶2∶3∶5 B.1∶2∶3∶4
C.60∶30∶20∶10 D.30∶15∶20∶12
4.在FeO、Fe2O3和Fe3O4中与等质量的铁元素相结合的氧元素质量比为( )
A.1∶3∶4 B.2∶3∶4
C.6∶9∶8 D.3∶8∶9
5.某强氧化剂RO3-中的R元素被Na2SO3还原成较低价态.如果还原2.4×10-3molRO3-需要Na2SO36×10-3mol(Na2SO3转变为Na2SO4),则反应后R元素的价态是( )
A.0 B. 1 C. 3 D. 4
6.A、B两种化合物均由X、Y两元素组成,已知A中Y的质量分数是0.44,B中Y元素的质量分数为0.345.A的化学式为YX2则B的化学式为( )
A.YX B.Y2X2 C.YX3 D.YX4
7.设x个氮原子的质量为1g,则阿伏加德罗常数可以表示为( )
A. ![]() mol-1 B.
mol-1 B. ![]() mol-1 C.14xmol-1 D.28xmol-1
mol-1 C.14xmol-1 D.28xmol-1
8.在反应3Cl2 6KOH ![]() KClO3 5KCl 3H2O中,还原剂与氧化剂的物质的量之比为( )
KClO3 5KCl 3H2O中,还原剂与氧化剂的物质的量之比为( )
A.1∶5 B.1∶3 C.5∶1 D.3∶1
9.把0.5molNa和0.5molMg分别投入到过量的m1g水和m2g盐酸中,分别得到溶液a和b.若m1=m2,则a与b的质量关系是( )
A.ma>mb B.ma<mb C.ma=mb D.无法确定
10.分别加热下列三种物质各100g
①KMnO4 ②KClO3(加少量MnO2,其质量不计其中) ③HgO完全反应后所放出O2的量由多到少的顺序是( )
A.①>②>③ B.②>①>③ C.①>③>② D.②>③>①
二、填空题
11.在KCl、ZnCl2、ZnSO4三种盐配成的混合溶液中,已知K 为0.1mol、Zn2 为0.25mol,Cl-为0.2mol,则SO42-为 mol.
12.在KCl与CaCl2的混合物中钾离子与钙离子的物质的量之比为5∶1,则该混合物中K的质量分数为 ,CaCl2的质量分数为 ,含有1mol氯离子的该混合物的质量为 .
13.0.2molKClO3中所含Cl原子数与 gCaCl2所含氯离子个数相等.
三、计算题
14.实验用滴管取20滴水,其体积为1mL(1g),则1滴水中含多少个水分子.
15.二价金属A和三价金属B的混合物9.00g与足量的盐酸反应放出1.10gH2.A的原子量为B的原子量的1/3,在混合物中A和B的原子个数比为1∶3,通过计算确定A、B的原子量各是多少?

参考答案:
【同步达纲练习】
一、1.D 2.B 3.C 4.C 5.AB 6.AC 7.B 8.A 9.C 10.D 11.D
二、12.(1)× (2)× (3)× (4)× (5)√ (6)×
13.不相;不相;相;不相 14.2∶8∶1;16∶4∶7;2∶8∶1 15.95g·mol-1;95;24.
三、16.A为Ca
【素质优化训练】
一、1.A 2.B 3.D 4.C 5.A 6.C 7.D 8.A 9.C 10.B
二、11.0.2 12.40.3%;23%;69 13.11.1
三、14.1.67×1021个 15.Ar(A)=9 Ar(B)=27
| |