|
练 习
一、选择题
1、除第一周期外,关于同周期主族元素的下列变化规律叙述中不正确的是
A、从左到右,原子半径逐渐减小。
B、从左到右,元素原子的氧化性减弱,还原性增强。
C、从左到右,元素最高正价数从1递增到7,负价由-4递变到-1
D、从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强。
2. 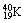 和 和 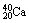 的阳离子的核外电子数 的阳离子的核外电子数
A.大于 B.小于 C. 等于 D. 不能确定
3、下列气态氢化物最稳定的是
A、HCl B、SiH4 C、H2S D、PH4
4、下列元素原子半径按从小到大顺序排列的是
(A)Cl、S、P (B)K、Na、Li (C)Al、Mg、Na (D)N、O、F
6.如下性质的递变中,不正确的是( )
A. HCl、H2S、PH3的稳定性依次增强
B. HClO4、H2SO4、H3PO4、H4SiO4的酸性依次减弱(相同条件下)
C. CsOH、KOH、LiOH 的碱性依次减弱
D. Na 、Mg2 、Al3 的氧化性依次减弱
7、下列事实不能用判断金属性强弱的是
A、1mol金属单质在反应中失去电子的多少
B、金属间发生的置换反应
C、金属元素的单质与水或酸反应置换出氢气的难易
D、金属元素的最高价氧化物对应的水化物的碱性强弱
8、某元素的气态氢化物的化学式为H2R,此元素最高价氧化物对应的水化物的化学式可能为: A、 H2RO3 B、H2RO4 C、HRO3 D、H3RO4
9、 已知An 、B(n 1) 、Cn-、D(n 1)-都有相同的电子层结构,则A、B、C、D、的原子半径从大到小顺序的是:
(A)DCAB (B)CDBA (C)ABDC (D)ABCD
10、元素的化学性质主要决定于
A、原子半径 B、原子的外层电子结构 C、元素化合价 D、元素的相对原子质量
11、下列各组指定原子序数,不能形成AB2型化合物的是
A、6和8 B、16和18 C、12和9 D、11和16
12、X元素能形成H2X和XO2两种化合物,该元素的原子序数是
A、13 B、14 C、15 D、16
15、将100mL2mol/L的含氧酸HnRO4溶液与200mL1.5mol/L的M(OH)a溶液混合,恰好完全反应,则元素R的化合价为:
A. 8 - 1.5a B. 5 C. 8-3a D. 6
二、填空题
16、用元素符号或化学式回答原子序数11~18的元素的有关问题:
(1)除稀有气体外,原子半径最大的元素是____;
(2)最高价氧化物对应的水化物的碱性强的碱是____;
(3)最高价氧化物对应的水化物呈两性的元素是____;
(4)最高价氧化物的水化物的酸性最强的酸是____;
(5)最高正价与负价绝对值相等的元素的气态氢化物是 _____ ;
(6)形成气态氢化物最稳定的元素是____;
17、用>或<号回答问题:
(1)酸性:H2CO3___H2SiO3,H2SiO3___H3PO4
(2)碱性:Ca(OH)2___Mg(OH)2, Mg(OH)2___Al(OH)3
(3)态氢化物稳定性:H2O___H2S,H2S___HCl
(4)还原性:H2O___H2S,H2S___HCl
18、A、B、C、三种元素具有相同的电子层数,B的原子序数比A大2,C的原子序数比B大4, 1mol的A单质与跟酸反应,能置换出1gH2,而A变为具有跟Ne原子相同的电子层结构的离子。
(1)可推知 A是____, B是_____, C是_____。
(2)A、B、C、三种元素的最高价氧化物的水化物的化学式分别为 _______,
________, _______ 。
答案:一、1、B 2B、3A、4A、5AC、6AD、7A、8B、9C、10AB、11D、12D、15A
二、16、(1)Na (2)NaOH (3)Al (4)HClO4 (5)SiH4 (6)HCl
17、(1)>,< (2)>,> (3)>,< (4)<,>
18、(1)Na、Al、Cl (2)NaOH、AL(OH)3、HClO4
|