|
一、选择题
1. 下列物质中属于纯净物的是( )
(A) 漂白粉
(B) 氯水
(C) 磷在氯气中燃烧的产物
(D) 液氯
2. 下列物质能使红墨水褪色的是( )
(A) 活性炭
(B) 二氧化碳
(C) 氯化钠溶液
(D) 酸化了的次氯酸钠溶液
3. 实验室制取下列各组气体时,所用气体发生装置相同的是( )
(A) 氧气和氯气
(B) 氯气和氢气
(C) 二氧化碳和氢气
(D) 氢气和氯化氢气体体
4.下列物质中不能通过单质直接化合制取的是( )
(A) 氯化铜
(B) 氯化钠
(C) 四氧化三铁
(D) 氯化亚铁
5. 下列有关实验现象的描述不正确的是( )
(A) 浓硫酸滴入浓盐酸中,产生白色烟雾
(B) 红磷在氯气中燃烧,产生白色烟雾
(C) 镁带在氯气中燃烧,产生白色的烟
(D) 氢气在氯气中燃烧,产生苍白色的火焰
6.下列说法中正确的是( )
(A) 漂白粉露置在空气中会变质
(B) 饱和氯水长期放置,颜色会逐渐变浅
(C) 燃烧反应一定要有氧气参加
(D) 次氯酸是一种不稳定的弱酸
7.下列操作不能得到氯化氢气体的是( )
(A) 把食盐放入浓硫酸中加热
(B) 加热浓盐酸
(C) 加热氯化钠溶液和稀硫酸的混合物
(D) 把浓硫酸注入浓盐酸中
8.下列反应利用了盐酸的弱氧化性的是( )
(A) 实验室利用盐酸和石灰石反应制取二氧化碳气体
(B) 浓盐酸和二氧化锰反应制氯气
(C) 盐酸和锌粒反应制取氢气
(D) 盐酸除去铁锈的反应
9.现有两瓶气体,分别是氯化氢和氯气。可以区别它们的方法或试剂是( )
(A) 观察颜色或打开瓶盖看有无白雾
(B) 湿润的淀粉试纸
(C) 硝酸银溶液
(D) 湿润的红色石蕊试纸或湿润的蓝色石蕊试纸
10.按氟、氯、溴、碘的顺序,对其氢化物性质变化规律的叙述
中,正确的是( )
(A) 稳定性依次减弱
(B) 溶解性依次减弱
(C) 水溶液的酸性依次减弱
(D) 水溶液的颜色依次加深
11.下列萃取与分液结合进行的操作(用煤油为萃取剂,从碘水中萃取碘)中,错误的是( )
(A) 饱和的碘水和煤油加入漏斗后,塞上口部的塞子,用一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来,用力振荡
(B) 静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通(准备放出液体)
(C) 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
(D) 最后,继续打着活塞,另用容器承接并保存上层液体
12.下列事实中,能说明氟的性质特别活泼的是( )
(A) 氢氟酸是弱酸
(B) 氢氟酸有剧毒
(C) 氟化钠是能杀灭地下害虫的农药
(D) 氟有XeF2、XeF4、XeF6、KrF2等化合物
13.向含有20.6 g溴化钠的溶液中通人氯气后,将溶液蒸干,所得固体质量为16.15 g,则下列判断正确的是( )
(A) 溴化钠全部被氧化
(B) 有一半的溴化钠参与了反应
(C) 有百分之八十五的溴化钠参与了反应
(D) 溴化钠没有参与反应
14.在50 g含有1.17 g氯化钠和0.84 g氟化钠的溶液中,滴入过量的硝酸银溶液,充分搅拌,静置,过滤,洗涤,干燥,称量,得到2.87 g的固体,由此可以得出的正确结论是( )
(A) 氯离子只有一部分参加了反应
(B) 氟离子只有一部分参加了反应
(C) 氟化银可以溶于水
(D) 固体是氯化银和氟化银的混合物
15.下列是实验室工作中经常遇到的一些问题,请给予正确处理。
(1) 下列各种物质,应该放在棕色瓶中保存的是( )
(A) 液溴
(B) 氯水
(C) 盐酸
(D) 溴化银
(2) 对于下列试剂的保存方法,错误的是( )
(A) 浓盐酸容易挥发,应盛在无色密封的玻璃瓶中
(B) 氟化氢水溶液有剧毒,盛放在磨口的玻璃瓶中
(C) 液溴容易挥发,应该盛放在用水封的细口棕色瓶中
(D) 碘容易升华,应该保存在盛有水的棕色试剂瓶中
(3) 下列物质的正确保存方法是( )
(A) 氢氟酸可以保存在用塑料盖盖好的玻璃瓶中
(B) 氯水可以盛放在棕色的细口瓶中
(C) 液溴盛放在用橡皮塞塞好的玻璃瓶中
(D) 固体碘放在棕色的细口瓶中
二、填空题
1.卤族元素包括( 、 、 、 )等元素(请写元素名称和元素符号)。它们在自然界里都以( )态存在。卤素的单质分子都是( )分子,而且卤素单质的性质有较大的差别,在常温常压下,( )是( )色的气体,( )是( )色的气体,( )是( )色的液体,( )是( )色的固体。它们的熔点、沸点随核电荷数的递增而逐渐( )。碘受热直接变成紫色的蒸气,这种现象叫( )。
2.卤族元素的原子结构的共同特点是最外层都有( )个电子,在化学反应中容易( )电子。差别之处是( )不同,( )不同,( )也不同,由此形成了卤族元素既基本相似但又有着一些差别的性质,它们的单质都是( )剂。卤素中氟的非金属性最强,氯、溴、碘,随着原子的增大而非金属性( )。
3.将灼热的铜丝插入到盛有氯气的集气瓶中,其现象是( ),反应结束后,向集气瓶中加入少量水并振荡,溶液呈( )色,再滴入硝酸银溶液,现象为( ),化学方程式分别为( )。
4.实验室新制备的氯水具有( )气味,呈( )色,说明氯水中含有( )分子。氯水能使蓝色石蕊试纸首先变成红色,然后很快褪色,这是因为氯水中有( )分子存在。氯气溶于水的化学方程式为( ),由此可知氯水是( )物。氯水中主要含有三种分子( 、 、 ),三种离子( 、 、 )。氯水经光照后,黄绿色逐渐消失,并放出无色的( )气,此反应的化学方程式为( )。
5.次氯酸根为( )价,其中氯元素是( )价。次氯酸是( )酸,由次氯酸与氢氧化钠反应可以制得一种钠盐,名称是( ),其反应的化学方程式为( )。若由氯气和氢氧化钠反应,则可以制得两种盐,名称为( ),其反应的化学方程式为( )。
6.漂白粉是( )和( )的混合物,其有效成分是( )。用漂白粉进行漂白时,需要使( )与( )或空气中的( )与( )反应,其反应的化学方程式为( )。若稀酸为盐酸时,则反应的化学方程式为( )。
7.将高锰酸钾与氯酸钾的固体混合物加热,可以得到气体甲。在反应后残留的固体中加入过量的浓硫酸并加热,可以得到另一种单质气体乙。则甲是( ),乙是( )。
8.用于感光材料的卤化物是( ),用于腐蚀玻璃的酸是( ),用于人工降雨的银盐是( ),用于清洗铁锈的无氧酸是( ),用于杀灭地下害虫的含氟物质是( )。
三、简答题
9.用5.85 g氯化钠与足量的浓硫酸混合微热,将生成的气体用100 mL水吸收,求所得盐酸中HCl的质量分数.如果将上述混合物加热至500 0C~600 0C,所得盐酸中HCl的质量分数一样吗?试说明原因。
四、计算题
10.用36.5%密度为1.18 g/mL的盐酸与一定量的二氧化锰共热。将产生的气体经过干燥,再与过量灼热的铜粉反应,生成氯化铜13.5 g,试计算被氧化的盐酸的体积是多少?
参考答案
一、选择题
1.D 2.AD 3.CD 4.D 5.A 6.BD 7.C 8.C 9.AD
10.A 11.D 12.D 13.B 14.C 15.(1)BD(2)BD(3)B
二、填空题
1. 氟F、氯Cl、溴Br、碘I、化合,双原子、F2、浅黄绿色,Cl2、黄绿色,Br2、深棕红色,I2 、紫黑色,升高、升华。
2.
 T、得到、电子层数、原子半径、得电子能力、氧化剂、减弱。 T、得到、电子层数、原子半径、得电子能力、氧化剂、减弱。
3. 铜丝燃烧、有棕色的烟,绿色、产生白色沉淀。Cu Cl2 CuCl2,CuCl2 2AgNO3=Cu(NO3)2 2AgCl↓
4. 刺激性,浅黄绿色,Cl2,HClO, Cl2 H2O=HCl HClO
混合物,H2O,Cl2,HClO; H ,Cl-,ClO- 氧气, 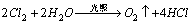 ; ;
5. -1, 1,弱,次氯酸钠 HClO NaOH=NaClO H2O
氯化钠、次氯酸钠 Cl2 2NaOH=NaCl NaClO H2O
6. 次氯酸钠、氯化钙、次氯酸钙、次氯酸钙、稀酸、二氧化碳、水蒸气,Ca(ClO)2 2H2O CO2=CaCO3↓ 2HClO ,Ca(ClO)2 2HCl=CaCl2 2HClO
7. O2,Cl2.
8. AgBr ,氢氟酸,AgI,盐酸,NaF。
三、简答题
9.3.5%,一样。提示:氯守恒。
四、计算题
10.16.95毫升。提示:4HCl~Cl2~CuCl2~2HCl
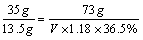 V=16.95 mL V=16.95 mL
|