|
物质结构单元测试
一、选择题(每小题有一个或两个选项符合题意)
1. 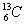 -NMR(核磁共振)可以用于含碳化合物的结构分析。 -NMR(核磁共振)可以用于含碳化合物的结构分析。 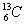 表示的碳原子 表示的碳原子
A.核外有13个电子,其中6个能参与成健
B.核内有4个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A.1对 B.2对 C.3对 D.4对
3.下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2) B.六氟化硫
C.二氟化氙 D.三氟化硼
4.下列分子的电子式书写正确的是
A.氨 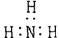 B.四氯化碳 B.四氯化碳 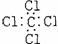
C.氮 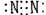 D.二氧化碳 D.二氧化碳 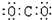
5.氯只有 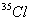 和 和 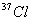 两各稳定同位素,它们在氯气中的原子数之比 两各稳定同位素,它们在氯气中的原子数之比 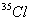 ︰ ︰ 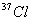 为3︰1。则分子量为70、72、74的氯气分子数之比可能是 为3︰1。则分子量为70、72、74的氯气分子数之比可能是
A.5︰2︰1 B.5︰2︰2 C.9︰3︰1 D.9︰3︰2
6.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A.x 2 B.x 4 C.x 8 D.x 18
7.下列说法正确的是
A.共价化合物中,一定不含有离子键
B.含有非极性键的物质,也可能是离子化合物
C.非极性键只存在于单质的分子中
D.不同元素组成多原子分子里的化学键一定都是极性键
8.下列关于物质性质变化的比较, 不正确的是:
A.酸性强弱: HI > HBr > HCl > HF B.原子半径大小: Na > S > O
C.碱性强弱: KOH > NaOH > LiOH D.还原性强弱: F- > Cl- > I-
9.下列化合物中既含有离子键又含有共价键的是
A.HNO3 B.NH4Cl C.CaCl2 D.H2SO4
10.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A.HF B.H3O+ C.NaH D.H2O2
11.下列叙述正确的是
A.同周期元素的原子半径为ⅦA族的为最大
B.在周期表中零族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
12.第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.原子半径比镁的原子半径大 D.碳酸盐难溶于水
13.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为
A.XY B.XY2 C.XY3 D.X2Y3
14.在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
15.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第IIIA族的元素 D.B是第3周期IVA族的元素
16.A、B、C、D、E 是同一短周期的五种元素, A和B的最高价氧化物对应的水化物呈碱性, 且碱性前者强于后者, C和D的气态氢化物的水溶液呈酸性, 且酸性前者强于后者, 五种元素形成的简单离子中,E的离子半径最小, 则它们的原子序数由大到小的顺序是
A.CDEBA B.ECDAB C.BAEDC D.BADCE
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
二、填空题:
17.填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号: 。
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行。
(4)所含元素超过18种的周期是第 、 周期。
(5)电子式:CCl4_______________ Na2O___________________
CO2_________________ NH4Cl__________________
(6)用电子式表示下列物质的形成过程:
MgCl2________________________________________
H2O__________________________________________
18.A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
19.X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是 ,其中和产物的化学式是 。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是 。
20.A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第______________周期______________族,它的最高价氧化物的化学式为______________。
(2)A是______________元素,B是______________元素,D是______________元素。
(3)A与D形成稳定的化合物的化学式为______________,判断该化合物在空气中是否变质的简单方法是______________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________。
21.有两种气体单质Am和Bn,已知2.4gAm和2.1gBn所含原子个数相同,分子个数比却为2∶3,又知A和B原子核内质子数都等于中子数,且A原子中L电子层所含电子数是K电子层的3倍,试推断:
(1)元素符号:A______________,B______________;
(2)Am中m值是______________。
22.现有A、B、C三种元素,已知它们的最外层电子数之和等于氧原子最外层电子数,其核内质子数之和不超过18,将它们分别跟O元素结合,均可生成两种氧化物;A O2→ 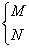 ,B O2→ ,B O2→ 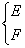 ,C O2→ ,C O2→ 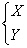 ,两种氧化物中氧元素质量分数:N>M,E>F,Y>X。M跟X化合,其生成物D可与E形成两种化合物P和Q,其中Q可用来治疗胃酸过多的疾病。据此推断下列元素或化合物(用元素符号或化学式表达) ,两种氧化物中氧元素质量分数:N>M,E>F,Y>X。M跟X化合,其生成物D可与E形成两种化合物P和Q,其中Q可用来治疗胃酸过多的疾病。据此推断下列元素或化合物(用元素符号或化学式表达)
A______________,B______________,C______________;M______________,N______________,E______________,F______________,X______________,Y______________;P______________,Q______________。
23.A、B、C、D、E为原子序数依次增大的主族元素,已知A、B、E三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:A______________,E______________,D______________。
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式_____________A、E两元素最高价氧化物的水化物相互反应的化学方程式______________________。
(3)比较D、E最高价氧化物对应水化物的酸性 。
24.A、B、C、D四种短周期元素的原子序数依次增大,A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4∶1。由A、C组成的两种化合物都为液态,其中一种乙为常用溶剂,乙中A、C原子数之比为2∶1,另一种为1∶1。由D、C组成的两种化合物丙和丁都为固态,丙中D、C原子数之比为1∶1,丁中为2∶1,试写出:
(1)化学式:甲______________,乙______________,丙______________,丁______________。
(2)B元素的最高价氧化物跟丙发生反应的化学方程式为______________________。
(3)甲、乙、丙、丁四种物质中属于碱性氧化物的是______________(可答某物质或无此类物质)。
三、计算题:
25.含重水(D2O)的水分解,得H2、HD、D2的混合气体,现有1L含重水0.017%(质量分数)的水(设其密度为1g/cm3),将其完全分解后,分离得到含HD,D2的混合气体,其平均相对分子质量为3.5。求D2和HD气体的体积(标准状况)。
26.有A、B、C、D四种元素,它们均为主族元素,最外层电子数分别为1、4、6、7,原子序数大小为D<B<A<C。又知C元素的一种同位素原子核中有46个中子,它的最高价氧化物的分子量与气态氢化物的分子量之比值为1.56。
(1)根据计算确定C元素的名称、符号,所在周期及族?
(2)推断A、B、D的元素名称和符号
(3)写出D、A单质分别与水反应的方程式
参考答案
1、D 2、B 3、A 4、C 5、A D 6、B 7、C 8、D 9、B 10、C
11、BC 12、CD 13、A 14、D 15、B 16、A
17、(1) 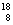 O (2)Ⅷ (3)17 (4)6、7(5)(6)略 O (2)Ⅷ (3)17 (4)6、7(5)(6)略
18.(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2)mA/MA=mB/MB+mC/MC(或MB<MA<MC;MC<MA<MB 以及其它合理答案)
(3)2种 Li2CO3 MgCO3
(4)MgCO3,BeCO3,Na2CO3 1.05
19.H2SO3,SO3,P2O5 Na3PO4、H2O 2P+5SO3=5SO2+P2O5
20.(1)三 ⅦA Cl2O7 (2)Na Mg O (3)Na2O2 观察该化合物的颜色是否变白 (4)Cl2 2OH-=Cl- ClO- H2O
21.(1)A∶O B∶N (2)3
22.H C Na H2O H2O2 CO2 CO Na2O Na2O2 Na2CO3 NaHCO3
23.(1)Na Si P
(2)Al(OH)3 NaOH=NaAlO2 2H2O NaOH HClO4=NaClO4 H2O
(3)H3PO4>H4SiO4
24.(1)CH4 H2O Na2O2 Na2O (2)2Na2O2 2CO=2Na2CO3 O2 (3)Na2O
25.(1)VD2=0.13L VHD=0.13L
解析 1L水中含重水 1L×1000g/L×0.017%=0.17g
重水(即D2O)的物质的量为 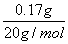 =0.0085mol =0.0085mol
重氢(D)的物质的量为0.0085×2=0.017
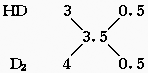
∴nHD∶nD2=1∶1
依D原子守恒可知:nHD 2nD2=0.017
∴nHD=nD2= 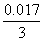 mol mol
∴VHD=VD2= 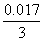 mol×22.4L/mol=0.1289L=0.13L mol×22.4L/mol=0.1289L=0.13L
26.(1)硒、Se、第四周期VIA族
(2)A、K B、Si D、F
(3) 2F2 2H2O===4HF O2↑
2K 2H2O===2KOH H2↑
|