|
硫和硫的化合物练习题(A)
班级 学号 姓名
一. 选择题 [ ]1.H2S气体通入下列物质中能产生黄色沉淀的是
A.SO2 B.NaOH溶液 C.盐酸 D.NaCl溶液
[ ]2.鉴别亚硫酸钠及硫酸钠溶液的方法是
A.加热法 B.加入氢氧化钠溶液 C.加入硫酸 D.加入硝酸钡溶液
[ ]3.工业上可以不经处理直接排放的气体是
A.SO2 B.Cl2 C.CO2 D.H2S
[ ]4.等体积的Na2SO4、KAl(SO4)2和Al2(SO4)3三种溶液分别与同浓度、同体积的BaCl2溶液恰好反应,则上述三种溶液物质的量浓度比为
A.1:2:3 B.3:2:1 C.6:3:2 D.2:3:6
[ ]5.SO2溶于水后所得溶液的性质是
A.有氧化性,无还原性,无酸性. B.有氧化性,有还原性,有酸性.
C.有还原性,无氧化性,无酸性. D.有还原性,无氧化性,有酸性.
[ ]6.下列物质中含有硫元素的是
A.黄铜矿 B.苏打 C.石膏 D.萤石
[ ]7.将等物质的量的SO2和Cl2混合后通入含有品红和Ba(NO3)2的混合溶液里,发生的现象是
①溶液很快褪色 ②溶液不褪色 ③有沉淀生成 ④溶液仍然透明
A.仅①和③ B.仅②和③ C.仅①和④ D.仅②和④
[ ]8.硫铁矿煅烧时,若转移11mol电子,此时参加反应的氧气的体积(标况)是
A.61.6L B.44.8L C.67.2L D.91.6L
[ ]9.能用H OH - =H2O离子方程式表示的化学反应是
A.NaOH溶液和盐酸反应 B.Fe(OH)3和硫酸溶液反应
C.Ba(OH)2溶液和硫酸反应 D.KOH溶液NaHSO4溶液反应
[ ]10.不慎误服了BaCl2可引起中毒,除服用大量鸡蛋清解毒外,还应服用
A.Na2CO3溶液 B.Na2SO3 溶液 C.Na2SO4 溶液 D.NaCl溶液
[ ]11.在pH=1的无色透明溶液中,不能大量共存的离子组是
A.MnO4-,Ag ,NO3-,Cl- B.Mg2 ,NH4 ,NO3 – ,Cl –
C.Ba2 ,K ,S2-,Cl- D.Zn2 ,Na ,NO3 -,SO4 2-
[ ]12.下列离子方程式正确的是
A. 碳酸钙跟醋酸反应:CaCO3 2CH3COOH=Ca2 2CH3COO- H2O CO2↑
B.金属钠跟水反应:Na 2H2O=Na 2OH - H2↑
C.硫化氢气体通入硫酸铜溶液中:S2- Cu2 =CuS↓
D.铜片插入硝酸银溶液:Cu Ag =Cu2 Ag
[ ]13.为了同时除去混在CO2气体中的杂质HCl和SO2,应选用的试剂是
A.NaOH溶液 B.Na2CO3溶液 C.饱和NaHCO3溶液 D.CaO固体粉末
[ ]14.室温下,在密闭容器中,将24mL硫化氢在30mL氧气中燃烧,冷却后恢复到原温度,密闭容器中压强是原压强的
A.0.5倍 B.0.55倍 C.0.37倍 D.0.33倍
[ ]15.把3.48gCuSO4·xH2O晶体加热到白色,质量不再改变后,冷却称其质量为2.40g,此晶体中x值应为 A.5 B.4 C.3 D.2
二. 填空题
16.写出下列物质的电子式:
H2O H2O2 Na2O2
H2S Na2S CS2
17.比较下列各组元素或化合物的性质(用大、小、强、弱表示):
(1)硫原子的半径比氧原子的半径 ,比硒原子的半径 .
(2)S2-的还原性比Cl-的还原性 ,比O2-的还原性 .
(3)H2S的稳定性比H2Se的稳定性 ,比H2O的稳定性 .
(4)H2SO4的酸性比HClO4的酸性 .
18.若检验某溶液中是否存在下列离子:SO32-,SO42-,CO32-,S2-,Cl-,Br-.I-,根据下列事实分别做出。填写适当结论:
(1)若溶液呈强酸性,不能大量存在的离子是 .
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是 .
(3)加入氯水后溶液仍为无色透明,不存在的离子是
19.有SO2和H2S的混合气体共2.5mol,充分反应后.测得还原产物比氧化产物少16g,原混合气体中SO2和H2S的质量分别是 或
20.有五种黑色粉末:炭、铁、氧化铜、二氧化锰和硫化亚铁。可用一种试剂区别,这种试剂是 。
鉴别时发生的离子反应方程式是:
21.Cu能和氯气、氧气、硫反应,写出反应的化学方程式,根据所得产物比较三种单质的氧化性强弱 。
22.某亚硫酸钠试剂已被部分氧化,为确定其纯度,要进行如下实验:①称取样品W1g;②将样品溶解;③给溶液加入稍过量的盐酸酸化;④过滤洗涤,干燥沉淀,称其质量为W2g,试回答:
(1)BaCl2溶液要用盐酸酸化的原因 。
(2)BaCl2溶液要稍过量的原因 。
(3)判断操作③是否完成的方法是 。
(4)判断沉淀是否洗净的方法是 。
(5)样品中亚硫酸钠的质量分数是 。
23.指出下列的用途或变化中利用了该物质的哪些性质
(1)医疗上广泛使用了3%的双氧水作为消毒杀菌剂 。
(2)硫化氢是一种剧毒物质,实验室常用酸性高锰酸钾溶液加以吸收 。
24.MnO2常用于实验室制取气体,指出下列实验中MnO2表现出来的性质
(1)MnO2和KClO3制O2 。
(2)MnO2和NaCl、浓H2SO4制Cl2 。
(3)MnO2和H2O2制O2 。
25.一瓶气体经化验只含有一种元素,能否说明它是一种纯净物?
为什么 ,例如: 。
三、计算题
26.将mg的铁粉与ng的硫粉均匀混合后,加热到红热后,冷却到室温,加入体积为多少的bmol/L的盐酸后恰好不产生气体?共产生标况下的气体的体积是多少?
【参考答案】
1、A 2、C 3、B 4、C 5、B 6、AC 7、B 8、A 9、AD 10、C 11、C 12、A 13、C 14、D 15、B
16、 略
17、(1)大、小(2)大、大(3)大、小(4)小
18、(1)SO32-、CO32-、S2-(2)SO42-(3)S2-、Br-、I-
19、96g和34g或32g和68g
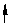 20、浓盐酸 (1)Fe 2H = Fe2 H2 (2)CuO 2H = Cu2 H2O 20、浓盐酸 (1)Fe 2H = Fe2 H2 (2)CuO 2H = Cu2 H2O
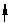 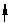 (3)MnO2 4H 2Cl- (3)MnO2 4H 2Cl- 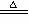 Mn2 Cl2 2H2O (4)FeS 2H = Fe2 H2S Mn2 Cl2 2H2O (4)FeS 2H = Fe2 H2S
21、Cu Cl2  CuCl2 2Cu O2 CuCl2 2Cu O2 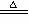 2CuO 2Cu S 2CuO 2Cu S 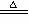 Cu2S Cl2>O2>S Cu2S Cl2>O2>S
22、(1)除去SO32-
(2)Ba2 与SO42-结合使SO42-完全转化为BaSO4
(3)取上层清夜少许于试管中滴加BaCl2溶液若无沉淀则沉淀完全
(4)取最后一次洗涤液加AgNO3溶液若无沉淀则沉淀完全
(5)1-142W2/233W1
23、⑴氧化性⑵还原性
24、⑴催化剂⑵氧化剂⑶催化剂
25、略
 26、0.4m L 26、0.4m L
|