|
单元测验试卷 实验 班姓名
一、选择题
1.氧化还原反应的实质是 ( )
A.氧元素的得与失 B.化合价的升降
C.电子的得失或偏移 D.分子中原子重新组合
2.关于电解质的下列说法中正确的是 ( )
A.在水溶液中和熔化状态下能导电的化合物
B.在水溶液中或熔化状态下能导电的物质
C.在水溶液中或熔化状态下能导电的化合物
D.在水溶液中或熔化状态下导电所需的离子由原物质本身电离出来的化合物
3.关于强电解质的叙述正确的是 ( )
A.在固体状态下能导电的物质 B.在水溶液里能导电的化合物
C.强酸、强碱和大多数盐属于强电解质
D.在水溶液里或熔化状态下几乎完全电离的化合物
4.下列电离方程式中,错误的是 ( )
A.H2CO3  H HCO3- HCO3- H HCO3- HCO3-  H CO32- B.H2SO4 H CO32- B.H2SO4  2H SO42- 2H SO42-
C.NaHS=Na H S2- D.NaHSO4=Na H SO42-
5.下列哪个反应可用Ca2 CO32-=CaCO3↓表示 ( )
A.向Ca(OH)2溶液中通入CO2 B.CaCl2溶液和BaCO3 混合
C.Ca(NO3)2溶液和Na2CO3溶液混合 D.Ca(OH)2溶液和Na2CO3溶液混合
6.下列反应中H2SO4只表现氧化性的是 ( )
A.2KOH H2SO4=K2SO4 2H2O B.C 2H2SO4(浓)  CO2↑ 2SO2↑ 2H2O CO2↑ 2SO2↑ 2H2O
C.H2S H2SO4(浓)= S↓ SO2↑ 2H2O D.Cu 2H2SO4(浓)  CuSO4 SO2↑ 2H2O CuSO4 SO2↑ 2H2O
7.对于电解质的导电能力,下列说法正确的是 ( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.导电能力强的溶液一定是浓溶液
C.相同温度下,导电能力强的溶液中离子个数一定多
D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强
8.下列实验操作正确的是 ( )
A.使用容量瓶配制溶液,移液时应洗涤烧杯2~3次
B.用100mL量简量取5.5mL稀盐酸 C.用托盘天平称量11.50g NaCl固体
D.使用滴定管前,用蒸馏水清洗后必须再用需要注入的溶液清洗
9.下列反应既是离子反应,又是氧化还原反应的是 ( )
A.氯化钠溶液中滴入硝酸银溶液 B.金属钠在氯气中燃烧
C.铁片置于硫酸铜溶液中 D.金属钠放入水中生成氢氧化钠和氢气
10.下列四个有水参加的化学反应中,水只作还原剂的是 ( )
A.电解水 B.铁和水蒸气作用生成四氧化三铁和氢气
C.氟气和水作用(2F2 2H2O=4HF O2) D.氯气和水反应(Cl2 H2O=HCl HClO)
11.在反应5NH4NO3  2HNO3 4N2 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是 A.1:3 B.5:3 C.5:8 D.5:4 ( ) 2HNO3 4N2 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是 A.1:3 B.5:3 C.5:8 D.5:4 ( )
12.已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是 ( )
A.2W- Z2=2Z- W2 B.2X- Z2=2Z- X2 C.2Y- W2=2W- Y2 D.2Z- X2=2X- Z2
13.以下关于化学反应KClO3 6HCl=KCl 3Cl2↑ 2H2O中,电子转移的方向和数的叙述中,正确的是 ( )
A.由Cl-1  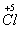 失去 6e- B.由5Cl-1 失去 6e- B.由5Cl-1  5 5 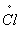 共失去5e- 共失去5e-
C.由 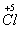  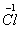 得到6e- D.由 得到6e- D.由 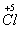  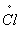 得到5e- 得到5e-
14.下列各组离子,在pH>7的溶液中能量共存,且溶液为无色透明的离子组是( )
A.K 、MnO4-、Cl-、SO42- B.Na 、NO3-、CO32-、Cl-
C.Na 、H 、NO3-、SO42- D.Na 、NO3-、S2-、Cl-
15.下列离子方程式书写正确的是 ( )
A.氢氧化铁与盐酸反应: H OH-=H2O
B.镁与硫酸反应: 2H =H2↑
C.氯化钙与碳酸钾两种溶液混合 Ca2 CO32-=CaCO3↓
D.盐酸和碳酸钙反应: CaCO3 2H =Ca2 CO2↑ H2O
16.在一定条件下发生如下反应:2KClO3 I2=2KIO3 Cl2,则下列推断正确的是( )
A.该反应属于置换反应 B.该反应中氧化剂为I2
C.该反应中还原剂为KClO3 D.该反应中KClO3被还原为Cl2,I2被氧化为KIO3
17.在xR yH O2=mR3 nH2O的离子反应中,系数m的值为 ( )
A.2x B.4 C. 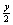 D.2 D.2
18.3个SO32-恰好将2个XO4-离子还原,则x元素在还原产物中的化合价是( )
A. 1 B. 2 C. 3 D.4
19.人类对于能源的利用大致可以分为三个时代,柴草能源、化石能源、多能源时代。以下说法正确的是 ( )
A.原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动
B.目前我国广大农村生火做饭使用的都是化石原料
C.多能源时代指的是新能源时代,包括有核能、太阳能、氢能
D.化石燃料的燃烧带来了很多大气污染物
20.下列叙述正确的是( )
A.葡萄糖在人体内氧化分解是个放热反应
B.某些物质在空气中燃烧是吸热反应
C.强酸强碱的中和反应是放热反应,弱酸、弱碱的中和反应是吸热反应
D.氢以前的活泼金属和盐酸或稀硫酸反应生成氢气全部都是放热反应
二、填空题
21.有以下反应方程式:
A.CuO H2  Cu H2O B.2KClO3 Cu H2O B.2KClO3  2KCl 3O2↑ 2KCl 3O2↑
C.Cl2 2NaOH=NaCl NaClO H2O D.2FeBr2 3Cl2=2FeCl3 2Br2
E.MnO4 4HCl  MnCl2 Cl2↑ 2H2O F.2NaBr Cl2=2NaCl Br2 MnCl2 Cl2↑ 2H2O F.2NaBr Cl2=2NaCl Br2
G.KClO3 6HCl=KCl 3Cl2↑ 3H2O H.HgS O2=Hg SO2
按要求将上述化学方程式序号填入相应括号内:
(1)一种单质使一种化合物中的一种元素被还原 ( )
(2)一种单质使一种化合物中的一种元素被氧化 ( )
(3)同一种物质中一种元素氧化另一种元素 ( )
(4)同一种物质中,同种元素间发生氧化还原反应 ( )
(5)不同物质的同种元素间发生氧化还原反应 ( )
(6)发生在不同物质间,只有部分元素被氧化或只有部分元素被还原的反应 ( )
(7)所有元素均参加氧化还原反应的是 ( )
22.标出下列反应的电子转移方向和数目,并填写有关内容:
氧化剂 ,
(1)4FeS 702  2Fe2O3 4SO2 氧化产物 2Fe2O3 4SO2 氧化产物
(2)2S 6KOH  2K2S K2SO3 3H2O 氧化剂 氧化产物 2K2S K2SO3 3H2O 氧化剂 氧化产物
还原剂 还原产物
离子方程式为:
23.完成下列离子方程式
(1)CO2 ( )= CO32- H2O
(2)( ) Ca2 2OH-=CaCO3↓ ( )
(3)(NH4)2SO4溶液与Ba(OH)2溶液混合加热
(4)Cu和AgNO3的溶液
三、判断题
24.某物质可能含有炭粉、CaCO3、CuO、Fe2O3中的一种或几种。现进行如下实验:
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体
(2)经冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,同时产生一种可燃性气体。
根据上述实验现象推断,该物质中一定含有 ,一定不含有 ,可能含有 。写出有关反应的化学方程式,属于氧化还原反应的,标出电子转移的方向和数目,并指出氧化剂、还原剂,属于离子反应的,写出离子方程式:
四、计算题
25.实验室用Cu与HNO3在常温下反应制取NO2气体,同时生成Cu(NO3)2和H2O,试回答:
(1)写出Cu与浓HNO3反应的化学方程式
(2)若实验室想制取23g NO2气体,则需要加入质量分数为63%的浓HNO3多少g?
(3)反应中同时有多少g HNO3被还原?
26.由NaCl、Na2SO4、KCl组成的混合溶液中,Cl-离子质量为71g,K 离子质量为39g,SO42-离子质量为96g,求溶液中Na 离子的质量。
参考答案
一、1.C 2.D 3.CD 4.BC 5.CD 6.BC 7.D 8.AD 9.CD 10.C 11.B
12.BC 13.BD 14.BD 15.CD 16.AD 17.D 18.D 19.CD 20.AD
二、21.(1)A (2)F (3)B (4)C (5)G (6)E (7)DH 22.(1)O2、Fe2O3 SO2,(2)S,K2SO3;S,K2S 3S 6OH-  2S2- SO32- 3H2O 23.略 2S2- SO32- 3H2O 23.略
三、24.碳粉 Fe2O3,CuO,CaCO3略。
四、25.(1)Cu 4HNO3(浓)  Cu(NO3)2 2NO2↑ 2H2O (2)100g (3)31.5g 26.69g Cu(NO3)2 2NO2↑ 2H2O (2)100g (3)31.5g 26.69g
|