|
硫酸典例剖析
[例1]向50 mL 18 mol·L-1 H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0.45 mol B.等于0.45 mol
C.在0.45 mol和0.90 mol之间 D.大于0.90 mol
解析:18 mol·L-1的H2SO4是浓硫酸,在50 mL中H2SO4的物质的量是0.90 mol 。铜与浓硫酸反应的化学方程式是:
Cu+2H2SO4=====CuSO4+SO2↑+2H2O
在“充分反应”的限定下,似乎被还原的H2SO4的物质的量是0.45 mol,但是,事实上随着反应的进行,H2SO4逐渐消耗,而且有水作为生成物之一逐渐积累,而使得硫酸逐渐被稀释,到一定程度时硫酸不再跟铜发生反应,可见被还原的H2SO4的物质的量小于0.45 mol。
解答本题的主要失误在于没有理解题意,没有按“被还原的H2SO4的物质的量”这一关键性的指导语去考虑问题。
答案: A
点评:本题通过金属铜与浓硫酸反应的半定量判断,考查思维的严密性与整体性,题目本身并不是一个计算题,也不含有多少计算因素,考查的形式是一种逻辑论证。同时,解题时,不能把着眼点只注意在“量”上,还必须注意“质”的问题,因为许多化学问题涉及到量变引起质变这一辩证思维方法。
[例2]三位学生设计了下述三个方案,并都认为:如果观察到的现象和自己设计的方案一致,即可确证试液中有SO 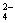 。 。
方案甲:
  试液 白色沉淀 沉淀不溶解 试液 白色沉淀 沉淀不溶解
方案乙:
  试液 无沉淀 白色沉淀 试液 无沉淀 白色沉淀
方案丙:
  试液 无沉淀 白色沉淀 试液 无沉淀 白色沉淀
试评价上述各方案是否严密,并分别说明理由。
答:方案甲
方案乙
方案丙
解析: 三个方案可作如下分析:
(1)方案甲先向试液加氯化钡溶液,生成的白色沉淀有两种可能:一种是与氯离子结合而生成的氯化银,一种是与钡离子结合而成的硫酸钡、亚硫酸钡、碳酸钡、磷酸钡(即试液中可能含有SO 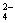 、SO 、SO 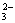 、CO 、CO 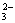 、PO 、PO 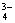 )。上述沉淀中只有亚硫酸钡、碳酸钡、磷酸钡能溶于盐酸,因而此方案不能确证试液中含SO )。上述沉淀中只有亚硫酸钡、碳酸钡、磷酸钡能溶于盐酸,因而此方案不能确证试液中含SO 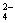 离子。 离子。
(2)方案乙先向试液中加入盐酸不产生沉淀,这排除了试液中含有Ag+离子的可能。然后再向此酸性溶液中加入氯化钡溶液,只有硫酸钡不溶于盐酸而呈白色沉淀,排除了其他离子的干扰,因而此方案是正确的。
(3)方案丙与方案乙相似,不同之处是用硝酸代替了盐酸,用硝酸钡溶液代替了氯化钡溶液。由于硝酸有强氧化性,可将SO 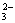 离子氧化成SO 离子氧化成SO 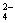 离子,因此不能排除SO 离子,因此不能排除SO 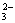 离子的干扰。 离子的干扰。
答案:甲方案不严密,因为含有Ag+而不含SO 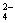 的无色透明溶液,也会出现此方案的现象;乙方案严密,因为含有SO 的无色透明溶液,也会出现此方案的现象;乙方案严密,因为含有SO 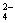 的无色透明溶液才会出现此方案的现象;丙方案不严密,因为含有SO 的无色透明溶液才会出现此方案的现象;丙方案不严密,因为含有SO 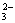 而不含SO 而不含SO 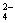 的无色透明溶液,也会出现此方案的现象。 的无色透明溶液,也会出现此方案的现象。
点评:SO 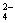 检验是中学化学的重要知识点,检验和离子推断时一定要排除其他离子的干扰。本题兼顾考查同学们的文字表述能力。 检验是中学化学的重要知识点,检验和离子推断时一定要排除其他离子的干扰。本题兼顾考查同学们的文字表述能力。
[例3]浓硫酸具有A.强酸性B.强氧化性C.高沸点、低挥发性,D.脱水性,E.吸水性等性质。以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入括号中
(1)用NaCl固体和浓H2SO4在加热条件下制氯化氢气体。( )
(2)用磷矿粉〔主要成分Ca3(PO4)2〕和硫酸反应制磷酸。( )
(3)热的浓硫酸分别与铜片、木炭和硫粉等反应。( )
(4)浓硫酸干燥H2、O2、Cl2、HCl和SO2等气体。( )
(5)常温下可以用铁或铝的容器贮存浓硫酸。( )
(6)胆矾放在盛浓硫酸的干燥器中变成白色粉末。( )
(7)不能用浓硫酸干燥HBr、HI和H2S等气体。( )
(8)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑。( )
解析:(1)浓硫酸具有高沸点、难挥发性,氯化氢气体易挥发。(2)磷酸是高沸点的中强酸,利用强酸与弱酸盐反应制弱酸的原理制磷酸。(3)浓硫酸在加热条件下将不活泼的金属铜转化成硫酸铜,不仅表现了浓硫酸的强氧化性,还表现了酸性。浓硫酸与碳、硫反应只表现强氧化性。(4)浓硫酸吸收混在上述气体中的杂质水蒸气。(5)常温下,浓硫酸和铝、铁反应,在金属表面生成一层薄而致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应。(6)浓硫酸间接吸收胆矾晶体中的结晶水,使之变成无水硫酸铜白色粉末。(7)浓硫酸具有强氧化性,而HBr、HI、H2S具有强还原性。(8)浓硫酸既具有酸的通性,可使酸碱指示剂变色,又具有脱水性,可使有机物炭化。
答案:(1)C (2)A (3)与Cu反应表现A、B;与S、C反应表现B (4)E (5)B (6)E (7)B (8)A、D
点评:硫酸在化学中扮演多项“角色”,同学们在学习时,一定要理解并掌握,在理解的基础上无须“死记硬背”。
[例4]实验证明铜不能在低温下与氧气反应,铜不与稀硫酸反应,但工业上却在废铜屑与热的稀硫酸混合物中,通入空气制硫酸铜溶液。(1)写出上述反应的化学方程式 。(2)利用铜制备硫酸铜溶液还有什么方法?写出反应的化学方程式 。比较哪一种方法好?为什么?
解析:在稀H2SO4存在的条件下,Cu与O2在加热条件下反应生成碱性氧化物CuO,迅速溶解在热的稀硫酸溶液中生成CuSO4。
第二种方法是先将铜在空气中加热使之生成CuO,再与稀硫酸反应。以上两种方法共同的特点是O2作为氧化剂,稀硫酸只起酸的作用。
第三种方法是在加热条件下使铜直接与浓硫酸反应,反应中硫酸不仅起酸的作用,还起氧化剂的作用,被还原为有毒气体SO2。
答案:(1)方法一:2Cu+2H2SO4(稀)+O2=====2CuSO4+2H2O
(2)方法二:2Cu+O2=====2CuO,CuO+H2SO4(稀)====CuSO4+H2O
方法三:Cu+2H2SO4(浓)=====CuSO4+SO2↑+2H2O
第一种方法最好。若制得1 mol CuSO4,第一、二种方法只需1 mol H2SO4,而第三种方法则要用2 mol H2SO4, 而且生成的SO2又造成大气污染。第一、二种方法比较,第一种方法在溶液中反应较易进行,且进行得充分。从以上分析可知第一种方法处理废铜屑最好。
点评:选取制备方法的原则一般是:①操作便利;②原料用量少且经济易得;③没有污染。
[例5]将质量分数为p%的硫酸与等体积的水混合后得到质量分数为q%的硫酸。则下列关于p、q的关系式中正确的是
A.q<p<2q B.p<2q C.p=2q D.p≥2q
解析:水的密度当视为1.00 g·mL-1,硫酸溶液的密度必大于1.00 g·mL-1。令题给q%的硫酸溶液的密度为ρ g·mL-1,显然ρ>1.00。设将V mL p% 的硫酸溶液与V mL水混合。混合后所得稀硫酸的质量分数为:
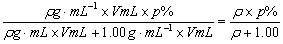
依题意有: 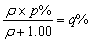
即有:ρp=ρq+q
即: 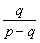 =ρ>1 q>p-q p<2q。 =ρ>1 q>p-q p<2q。
显然,若ρ<1,则p>2q。
本题也可巧解:设加入与p% H2SO4等质量的水,加入后必然使q%= 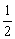 p%。但因水的 p%。但因水的
ρ(H2O)小于ρ(H2SO4),故等体积水的质量必然小于H2SO4溶液的质量,加入后导致溶液浓度大于 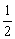 p%。 p%。
答案:B
点评:通过本题可以得到以下结论。密度大于 1.00 g·cm-3的溶液被等体积水稀释后,其溶质的质量分数将大于稀释前的 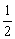 ;而密度小于 1.00 g·cm-3的溶液被等体积的水稀释后,其溶质的质量分数将小于稀释前的 ;而密度小于 1.00 g·cm-3的溶液被等体积的水稀释后,其溶质的质量分数将小于稀释前的 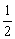 。 。
[例6](1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: 。
(2)试用下图6—3所列各装置设计一个实验,来验证上述反应所产生的各种产物。 |
编号 |
① |
② |
③ |
④ | |
装置 |
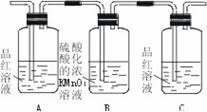
|
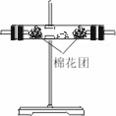
|
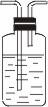
|
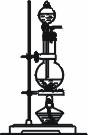
| |