|
物质结构、元素周期律单元测试题
一、 选择题(每小题有一个选项符合题意,共60分。)
1. 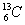 -NMR(核磁共振)可以用于含碳化合物的结构分析。 -NMR(核磁共振)可以用于含碳化合物的结构分析。 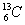 表示的碳原子 表示的碳原子
A.核外有13个电子,其中6个能参与成健
B.核内有4个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
2.关于化学键的叙述正确的是
A.离子键是由阴离子和阳离子间的静电吸引而形成的
B.共价化合物可能含离子键
C.离子化合物只含离子键
D.共价化合物不含离子键
3.下列分子的电子式书写正确的是
A.氨 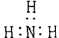 B.四氯化碳 B.四氯化碳 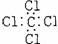
C.氮 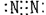 D.二氧化碳 D.二氧化碳 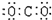
4.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd、…的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号元素应位于周期表中的
A.第6周期ⅣA族 B.第7周期ⅥA族
C.第7周期Ⅷ族 D.第8周期ⅥA族
5.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A.x 2 B.x 4 C.x 8 D.x 18
6.a元素的阴离子、b元素的阴离子和c元素的阳离子具有相同的电子层结构。已知a的原子序数大于b的原子序数,则a、b、c三种离子径大小的顺序是
A.a>b>c B.b>a>c C.c>a>b D.c>b>a
7.下列关于物质性质变化的比较, 不正确的是:
A.酸性强弱: HI > HBr > HCl > HF B.原子半径大小: Na > S > O
C.碱性强弱: KOH > NaOH > LiOH D.还原性强弱: F- > Cl- > I-
8.下列化合物中既含有离子键又含有共价键的是
A.HNO3 B.NH4Cl C.CaCl2 D.H2SO4
9.A和B是前三周期的元素,它们的离子A2-、B3 具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B B.原子半径:A>B
C.离子半径:A2->B3 D.质量数:A>B
10.下列叙述不正确的是
A.同周期元素的原子半径ⅦA族的为最小
B.在周期表中零族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
11.第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.原子半径比镁的原子半径小 D.碳酸盐难溶于水
12.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为
A.XY B.XY2 C.XY3 D.X2Y3
13.在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
14.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第IIIA族的元素 D.B是第3周期IVA族的元素
15.国际无机化学命名委员会在1989年做出决定,把长式周期表原先的主、副族及族号取消,由左至右改为第1—18列,如碱金属族为第1列,稀有气体元素为第18列。按照这个规定,下列说法不正确的是
A.第15列元素的最高价氧化物为R2O5
B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸
D.第16、17列元素都是非金属元素
16.若原子R的质量数为A,Rn-核外电子数为x,则W克Rn-所含中子为
A.(A-x n)mol B.(A-x-n)mol
C. 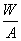 (A-x n)mol D. (A-x n)mol D. 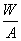 (A-x-n)mol (A-x-n)mol
17.镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是
A. 在化合物中呈 2价 B.单质能使水分解,放出氢气
C.镭比钙的金属性弱 D.碳酸镭难溶于水
18.在两种短周期元素组成的化合物中,若它们的原子个数之比为1∶3,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是①a=b 4 ②a b=8 ③a b=30 ④a=b 8
A.只有②③ B.只有②③④ C.只有③④ D.①②③④
19.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列能支持这种观点的是
A.HF B.H2O C.NaH D.H2O2
20.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A.1对 B.2对 C.3对 D.4对
二、填空题:(4小题,共40分。)
21.A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:(12分)
(1)元素C位于第__ 周期__ 族,它的最高价氧化物的化学式为__ 。
(2)A是__ 元素,B是__ 元素,D是 元素。
(3)A与D形成稳定的化合物的化学式为___ ,判断该化合物在空气中是否变质的简单方法是_______ 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___________ 。
22.A、B、C、D、E为原子序数依次增大的主族元素,已知A、B、E三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:(8分)
(1)写出下列元素符号:A_____,E_____,D______。
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式_______ ,A、E两元素最高价氧化物的水化物相互反应的化学方程式____ 。
(3)比较D、E最高价氧化物对应水化物的酸性 。
23.有A、B、C、D四种元素。已知:(1)它们均为周期表中前20号元素,C、D在同一周期,A、B在同一主族;(2)它们可以组成化合物B2C2、A2C、DC2等;(3)B的阳离子与C的阴离子的核外电子排布相同;(4)B2C2同A2C或DC2反应都生成C2的气体,B与A2C反应产生气体A2,A2与气体C2按体积2:1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下)。请回答下列问题:(11分)
(1)写出A、B、C、D四种元素符号: A B C D
(2)在B2C2、A2C和DC2中,属于离子化合物的是 ,其电子式是 。属于共价化合物的是 ,其结构式是 。
24.有A、B、C、D四种元素,它们均为主族元素,最外层电子数分别为1、4、6、7,原子序数大小为D<B<A<C。又知C元素的一种同位素原子核中有46个中子,它的最高价氧化物的分子量与气态氢化物的分子量之比值为1.56。(9分)
(1)根据计算确定C元素的名称 、符号 ,所在周期 及族 .
(2)推断A、B、D的元素符号 、 、 。
(3)写出D、A单质分别与水反应的方程式 .
答题卡
姓名: 班级: 学号:
一、 选择题 |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
答案 |
|
|
|
|
|
|
|
|
|
| |
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 | |
答案 |
|
|
|
|
|
|
|
|
|
| |