|
可能用到的原子量:C-12,O-16,H-1,Si-28, Ca-40, Fe-56, Na-23
1、制造太阳能电池需要高纯度的硅,工业上由粗硅制高纯度硅常通过以下反应实现:
(1)Si(s) 3HCl(g) 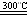 SiHCl3(g) H2(g) SiHCl3(g) H2(g)
(2)SiHCl3 H2 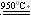 Si 3HCl Si 3HCl
关于上述条件下的两个反应的叙述中正确的是:
A、两个反应都是置换反应 B、反应(1)是复分解反应
C、上述反应是可逆反应 D、两个反应都不是氧化-还原反应
2、已知新发现的114号元素X,它的原子核外的最外层上有4个电子,下列有关叙述正确的是
A.X有稳定的气态氢化物XH4 B.X的最高价的氧化物化学式是XO2
C.X为非金属元素 D.X的最高价的氧化物对应的水化物的化学式是H4XO4
3、近年来,科学家发现一种新分子,它具有空心的类似足球状结构,化学式为C60,下列说法正确的是
A.C60是一种新型化合物 B.C60和石墨都是碳的同素异形体
C. C60中含离子键 D.C60的摩尔质量为720
4、下列离子方程式中不正确的是
A.碳酸氢钙溶液跟盐酸反应 Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
B.碘化钾溶液跟适量溴水反应 2I-+Br2====I2+2Br-
C.将金属钠投入水中 2Na+2H2O====2Na++2OH-+H2↑
D.将氯气通入氯化亚铁溶液中 2Fe2++Cl2====2Fe3++2Cl-
5、熔融烧碱应选用的器皿是
A.石英坩埚 B.普通玻璃坩埚 C.生铁坩锅 D.陶瓷坩埚
6、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 Mpa下合成出金刚石,具有深远意义。下列说法不正确的是
A. 由二氧化碳合成金刚石是化学变化 B. 金刚石是碳的一种同位素
C. 钠被氧化最终生成碳酸钠 D. 金刚石中只含有非极性共价键
7、常温下,能与SiO2发生反应的物质是
A.烧碱 B.浓硫酸 C.水 D.氧化钙
8、下列说法正确的是
A.因为玻璃中含SiO2,故玻璃试剂瓶不能盛装碱液
B.水玻璃在空气中能变浑浊,水泥无论在空气中或水中都能硬化
C.制备光导纤维的重要原料是玻璃
D.SiO2既能溶于强碱液,又能与氢氟酸反应,故它是两性氧化物
9、欲观察氢气燃烧的颜色,燃气导管口的材料最好是
A.钠玻璃 B.钾玻璃 C.石英玻璃 D.铜管
10、Al2O3·2SiO2·2H2O是
A.混合物 B.两种氧化物的水化物
C.硅酸盐 D.铝酸盐
11、下列各物质中属于纯净物的是
① 水玻璃 ② 水泥 ③ 普通玻璃 ④ 漂白粉 ⑤.Na2CO3·10H2O ⑥ 氯水 ⑦ 液氯 = 8 \* GB3 ⑧纯净的盐酸
A、① ④ B、 = 1 \* GB3 ①⑤ = 7 \* GB3 ⑦ = 8 \* GB3 ⑧ C、① ⑤ ⑥ D、⑤ ⑦
12、磷酸钙是陶瓷,也是一种新型无机非金属材料,它可用于制成人造骨骼,这是利用了这类材料的
A.耐高温的特性 B.电学特性 C.光学特性 D.生物功能
13、下列材料的特征及用途的说法不正确的是
A.氧化铝陶瓷具有两性,可用来制造人造牙齿
B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维传导光的性能很强,是非常好的通讯材料
D.人造刚玉硬度高,用于制造刚玉球磨机
14、下列溶液可以盛放在玻璃试剂瓶中,但不能用磨口玻璃塞的是
A.硅酸钠溶液 B.氢氟酸 C.浓硫酸 D.氯化钠溶液
15、.陶瓷已广泛应用于生活和生产中,下列不属于陶瓷制品的是
A.电器中的绝缘瓷管 B.实验室中的坩埚
C.实验室中的试管 D.建筑上烧制的砖瓦
16、下列关于材料的叙述不正确的是
A.传统的无机材料虽有不少优点,但质脆经不起热冲击
B.新型无机非金属材料虽然克服了传统无机材料的缺点,但强度比较差
C.高温结构材料具有能承受高温、不怕氧化、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.新型无机非金属材料特性之一是具有电学特性
17、人造骨是一种具有生物功能的新型无机非金属材料。它类似于人骨和天然牙的性质和结构。人造骨可以依靠从人体液中补充某些离子形成新骨。可在骨骼接合界面产生分解、吸收、析出等反应,实现骨骼牢固结合。人造骨植入人体内需要吸收人体中( )离子形成新骨。
A.Ca2+ B.Cl- C.Na+ D.SO 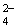
18、硅酸铜钡是当今用最新科学技术才合成的一种物质,然而科学家惊奇地发现,我国秦朝兵马俑用的一种颜料竟也是硅酸铜钡。由以上事实推测关于硅酸铜钡的说法错误的是
A.易溶于水 B.难溶于水 C.属于硅酸盐 D.属于纯净物
19、.纳米科技是跨世纪新科技,将激光束的宽度聚焦到纳米范围内,可修复人体已损坏的器官,对DNA分子进行超微型基因修复,把令人类无奈的癌症、遗传疾病彻底根除。纳米科技是人类认识自然的一个新层次,1 nm 等于
A.10-6 m B.10-9 m C.10-10 m D.10-12 m
20、与普通玻璃具有相同组成的是( )
A. 光学玻璃 B.有色玻璃 C.钢化玻璃 D.水晶玻璃
21、有一无色气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下处理(假定每次处理均反应完全):
(1)通过碱石灰时,气体体积变小;
(2)通过赤热的氧化铜时,固体变为红色;
(3)通过白色硫酸铜粉末时,粉末变为蓝色;
(4)通过澄清石灰水时,溶液变浑浊。
由此可以确定原无色气体中:一定含有
A. CO2、CO、H2O(g)、H2 B. H2、CO C. H2、CO2 D. H2、CO H2O
22、二氧化硅是酸酐的原因是
A.它溶于水得相应的酸 B.它对应的水化物是可溶性强酸
C.它与强碱反应只生成盐和水 D.它是非金属氧化物
23、在碳族元素中,从上到下逐渐减小或减弱的是
A、 原子的最外层电子数 B、气态氢化物的稳定性 C、单质的还原性 D、原子半径
24、下列几种酸中,酸性最弱的是
A、碳酸 B、硅酸 C、磷酸 D、高氯酸
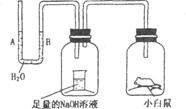 25、请据图问答,经数小时后,u形管A、B两处的液面会出现下列哪种情况(实验装置里的空气足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响) ( ) 25、请据图问答,经数小时后,u形管A、B两处的液面会出现下列哪种情况(实验装置里的空气足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响) ( )
A.A处上升,B处下降 B.A、B两处都下降
C.A处下降,B处上升 D.A、B两处都不变
26、近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是 ( )
A.提高汽油燃烧效率 B.降低汽油成本 C.避免铅污染大气 D.铅资源短缺
27、控制“温室效应”可能而有效的措施是( )
A.减少煤和石油的燃烧 B.控制全球人口的急剧膨胀
C.保护森林植被,多种树木 D.工业用煤改用天然气
28、下列各组离子在碱性条件下能大量共存的是( )
A.Na 、Cl-、Al3 、Ca2 B.K 、HCO3-、CO32-、SiO32-
C.Na 、CO32-、SiO32-、AlO2- D.Ca2 、Cl-、SO42-、CO32-
29、下列变化不可能通过一步反应实现的是( )
A.Na2CO3→Na2SiO3 B.Si→SiO2
C.SiO2→H2SiO3 D.CuSO4→CuCl2
30、除去SiO2固体中混有的CaCO3 固体方法正确的是( )
A.加水过滤 B.加热 C.加盐酸、过滤 D.加NaOH溶液、过滤
二、填空题(22分)
31(6分)、NaHCO3、Na2SiO3、K2SO4三种溶液中:
(1)只能跟H+反应的是__ _____,反应的离子方程式为___ ___。
(2)既能跟H+反应,又能跟OH-反应的是___ ____,反应的离子方程式
____ __,__ _____。
32(4分)、正长石的化学式为KAlSi3Ox,则x= ,把正长石写成氧化物的形式 。
33(2分)、矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土 [Al2Si2O5(OH)4] ,此反应的离子方程式为:2KAlSi3O8+2CO2+7H2O====2K++2HCO 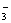 +4H2SiO3+Al2Si2O5(OH)4,这个反应能够发生的原因是 。 +4H2SiO3+Al2Si2O5(OH)4,这个反应能够发生的原因是 。
34(6分)、在碳族元素中,非金属性最强的元素是_______,金属性最强的元素是_______,单质能作半导体的元素是_______,+2价最稳定的元素是 ,气态氢化物最稳定的是_______,最高氧化物水化物酸性最强的是_____ ___。
35(4分)、硅化氢(SiH4)在空气中能自燃,根据甲烷燃烧的化学方程式,写出硅化氢自燃的化学方程式 。此反应中硅化氢是 (得到,失去)电子,作为 剂。
三、实验题(14分)
36(7分)、A、B、C、D、E五种物质的转化关系如下图
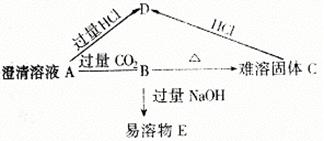
= 1 \* GB2 ⑴已知A为二元碱,其金属阳离子核外有18个电子,写出各物质的化学式:A_______、C_______、E_______。
(2)写出下列两个变化的离子方程式
B→D_________________________。
A→B______________ _______。
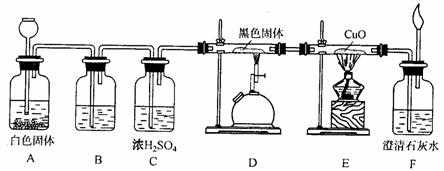
37(7分)用下图组装实验可以研究CO的还原性:
填写下列空白:
(1)从A的长颈漏斗应加入的试剂是______________(填编号)
A.稀硫酸 B.浓硫酸 C.稀盐酸 D.浓硝酸
(2)装置B中最适宜的试剂是_______ __。
(3)装置D中发生反应的化学方程式是_____________________________________。
(4)装置E中发生的现象是___________________________ __________
(5)必须用装置C吸收除去气体中水蒸气的理由主要是_________________________。
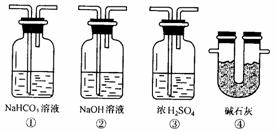
(6)若根据F中石灰水变浑浊的现象也能确认CO具有还原性,应在图中装置______________与______________之间连接下图的哪一种装置______________(填编号)。
四、计算题(4分)
38、把9gSiO2和 20gCaCO3混合物在高温下加热到质量不再改变。试计算:(1)生成CO2在标准状况下的体积;(2)反应后的固态物质的物质的量。
寿昌中学《硅和硅酸盐工业》单元测试题答题卷
  一、选择题(每小题2分) 一、选择题(每小题2分)|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 | |
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
题号 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 | |
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| | ![]() 2CO (4)黑色粉末逐渐变为红色
2CO (4)黑色粉末逐渐变为红色 ![]() CO H2,而H2可还原CuO
CO H2,而H2可还原CuO ![]() CaSiO3 CO2↑ CaCO3
CaSiO3 CO2↑ CaCO3 ![]() CaO CO2↑
CaO CO2↑