|
高一化学下学期期末考试
(考试时间:90分钟;满分100分)
班级 姓名 学号
说明:1、本卷分第I卷(选择题)和第II卷(非选择题)两部分。
2、第I卷(选择题)的答案请用2B铅笔涂在机读卡上。
3、可能用到的相对原子质量:H-1 O-16 S-32 Cu-64
第I卷(选择题,共45分)
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意。
1、下列物质中,能直接用作半导体材料的是
A、金刚石 B、 石墨 C、 晶体硅 D、 锡
2、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的这种同位素应表示为
 A A 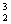 He B He B  He C He C 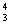 He D He D 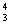 He He
3、据报道,不仅氟里昂(如CCl2F2)会破坏臭氧层,氮肥大量使用也会破坏臭氧层。原因是:氮肥分解过程会释放出氮氧化合物(如NO)。当NO进入大气层时,会引发破坏O3的循环,过程如下:O3==O2 O;NO O3==NO2 O2;NO2 O=NO O2 。上述过程总反应为:2O3==3O2 。在破坏O3的整个循环中,NO是
A、反应物 B、生成物 C、催化剂 D、中间产物
4、下列试剂保存方法不正确的是
A、NaOH溶液保存于带橡胶塞的试剂瓶中 B、液溴保存于有水作液封的棕色试剂瓶中
C、金属钠保存于用煤油作液封的试剂瓶中 D、过氧化钠粉末可以保存于敞口容器中
5、下列反应中既能放出气体,又不是氧化还原反应的是
A、钠和水反应 B、过氧化钠和水反应
C、纯碱和盐酸反应 D、小苏打与烧碱反应
6、下列关于碳和硅的叙述中,不正确的是
A.最高价氧化物都能与氢氧化钠溶液反应 B.单质在加热时都能跟氧气反应
C.氧化物都能溶于水生成相应的酸 D.碳和硅都有同素异形体
7、下列物质无法由两种单质直接化合得到的是
A、FeCl3 B、SO3 C、Al2S3 D、Cu2S
8、下列各组离子中,能够在同一溶液中大量共存的是
A、CO32-,H ,Na ,NO3- B、H ,Ag ,Cl-,SO42-
C、K ,NH4 ,Cl-,OH _ D、OH _,NO3-,K ,Na
9、氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生。下列叙述中不正确的是
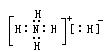 A、NH4H的电子式为: A、NH4H的电子式为:
B、NH4H固体投入少量水中,有两种气体产生
C、NH4H中的H– 离子半径比锂离子半径大
D、NH4H中氢离子可被还原成氢气
10、下列情况下产生褪色现象的原因与氧化还原反应无关的是
A、SO2使品红溶液褪色 B、Na2O2使有色物质褪色
C、氯水使有色物质褪色 D、O3使有色物质褪色
11、科学研究表明,硒元素可以影响人体内某种酶的活性,增加致癌物质在体内的控制率与排出率,从而起到抗癌作用。下列关于硒元素的推断,不正确的是( )
A、硒的非金属性比溴弱 B、最高价氧化物对应的水化物是酸
C、H2Se稳定性比H2O强 D、在化合物中常呈-2、 4、 6价
12、X和Y为两种主族元素,其原子的最外层电子数分别为1和6,则X和Y两种元素所形成的化合物( )
A、一定是离子化合物 B、一定是共价化合物
C、一定形成X2Y型化合物 D、以上答案均不正确
13、若X、Y为两种短周期元素,当它们对应的微粒属于下列何种情况时:①对应的原子具有相同的电子层数;②对应的离子具有相同的电子层数;③X– 与Y原子具有相同的电子层数;④X与Y 具有相同的电子层数。可推知X、Y两种元素必然属于同一周期元素( )
A、① B、①③ C、①②③ D、①②③④
14.下列关于物质性质变化的比较, 不正确的是
A、 酸性强弱: HI > HBr > HCl > HF
B、 原子半径大小: Na > S > O
C、 碱性强弱: KOH > NaOH > LiOH
D、 还原性强弱: F- > Cl- > I-
15、1999年是人工合成元素的丰收年,美国等国的科学家先后合成了原子数为114、116、118等的元素。根据原子结构理论和元素周期律知识,下列关于114号元素的说法中不正确的是( )
A、该元素在第七周期第ⅣA族 B、该元素形成的单质能与盐酸反应
C、该元素是非金属元素 D、该元素原子半径比碳原子大
第II卷(非选择题,共55分)
二、填空题(每空1分,共20分)
16、(1)写出水的电子式
(2)用电子式表示氯化镁的形成过程
17、浓硫酸的性质归纳起来有五点:(A)在水溶液中电离出H ,具有强酸性(B)具有高沸点、难挥发性(C)具有吸水性(D)具有脱水性(E)具有强氧化性。请你用相应的序号填入在空格里。
⑴ 电镀工业上常用来清除铁锈 ;
⑵亚硫酸钠中加入浓硫酸产生SO2气体 ,化学方程式 ;
⑶铜跟浓硫酸共热反应 ,化学方程式 ;
⑷实验室制氯化氢气体 ,化学方程式 ;
18、下列分子中,含有离子键的物质是____ ____,含有极性键和非极性键的物质是______ __,由极性键构成的非极性分子是_____ ___,含有极性键的极性分子是_____ ___。(全对才给分)
①HCl、 ②H2O2、 ③NH4Cl、 ④Na2O2、 ⑤KOH、 ⑥CO2、 ⑦CCl4
19、有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
元素名称: A __ _____ B _____ _ C ____ ___ D ___ ____
20、BGO是我国科学家研制的一种新型晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验中,它是锗酸铋的简称,该物质可以看作是由锗和铋(元素符号为Bi)两种元素的氧化物所形成的复杂氧化物。
(1)锗的元素符号是 。
(2)锗原子核内有 个质子。
(3)BGO中锗、铋和氧的原子个数比为3∶4∶12;且锗处于其最高价态。由此可推知BGO晶体中所含铋的氧化物的化学式为 。
三、实验题(本题共20分):
21、(8分)写出除去下列物质中少量杂质的方法及有关化学方程式或离子方程式。
(1)除去硫酸钾溶液中的碳酸钾。方法是 。
离子方程式是 。
(2)除去CO2中的SO2。方法是 。
化学方程式是 。
(3)除去石灰石中的二氧化硅。方法是 。
化学方程式是 。
(4)除去Fe2O3中的Al2O3。方法是 。
离子方程式是 。
22、(12分)、亚硫酸是SO2的水溶液,具有强还原性。下图为没画完全的装置图,用来做浓硫酸与某物质共热实验。实验时除浓硫酸和反应物外,只还有:酚酞、溴水、NaOH、Ca(OH)2、淀粉—KI和品红等溶液。
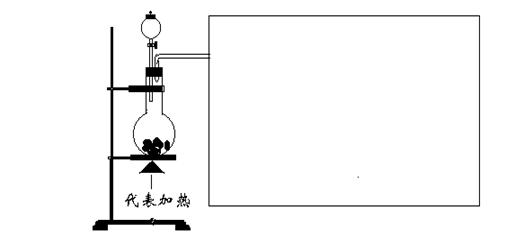
(1)若圆底烧瓶中的物质是铜。实验开始时,圆底烧瓶中可以观察的现象是 ,
, 。如果要检验该反应的还原产物,请在图中画出所用的仪器和所用的试剂,并指出能观察到的现象。
(2)若上图中圆底烧瓶中固体是木炭:
①请写出烧瓶中发生反应的化学方程式: 。
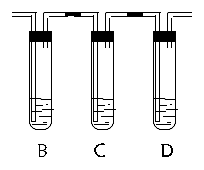 ②为检验该反应的氧化产物和还原产物,某学生对上图的方框中作补充如下。指出下列各实验装置的作用(说明:B和C中均装溴水,D中装Ca(OH)2溶液): ②为检验该反应的氧化产物和还原产物,某学生对上图的方框中作补充如下。指出下列各实验装置的作用(说明:B和C中均装溴水,D中装Ca(OH)2溶液):
 (B) 。 (B) 。
(C) 。
(D) 。
五、计算题(本题共15分)
23、(11分)用密度为1.84g/cm3、H2SO4的质量分数为98%的浓硫酸与铜反应,生成的 SO2气体在标准状况时的体积为11.2 L 。计算:
(1)参加反应的铜的质量
(2)浓硫酸中H2SO4的物质的量浓度。
(3)在反应中被还原的浓硫酸的体积。
 24、(4分)如图所示,密闭容器中有一个可以左右滑动的密封的隔板。在常温下,左侧装入N2,右侧装入H2和O2的混合气体,隔板正处于容器长度的1/4处静止不动,用电火花引燃H2和O2的混合气体,充分反应后,恢复至起始温度,隔板处于容器的正中间,静止不动。 24、(4分)如图所示,密闭容器中有一个可以左右滑动的密封的隔板。在常温下,左侧装入N2,右侧装入H2和O2的混合气体,隔板正处于容器长度的1/4处静止不动,用电火花引燃H2和O2的混合气体,充分反应后,恢复至起始温度,隔板处于容器的正中间,静止不动。
试计算试计算反应前H2和O2的体积比。(只要求写出简要过程)
下学期高一化学期末考试答案
一、选择题 (每小题3分,共45分)
1、C 2、A 3、C 4、D 5、C 6、C 7、B 8、D
9、D 10、A 11、C 12、D 13、B 14、D 15、C
二、填空题 (每空1分,共20分)
16、(略)
17、 ⑴清除铁锈 A ;
⑵产生SO2气体A,化学方程式Na2SO3 H2SO4=Na2SO4 SO2 H2O;
⑶共热反应 AE ,化学方程式 Cu 2H2SO4(浓)eq \o(\s\up 5( △),\s\do 2( =)) △ =CuSO4 SO2 2H2O;
⑷制氯化氢气体 AB ,化学方程式2NaCl H2SO4(浓)eq \o(\s\up 5( △),\s\do 2( =)) △ =Na2SO4 2HCl;
18、③④⑤, ②, ⑥⑦, ①②
19、名称: A 碳 B 氧 C 钠 D 硫
20、(1)Ge (2) 32 (3) Bi2O3
四、实验题 (21题8分, 22题12分, 共20分)
21、(1)加入适量的硫酸 2H CO32- = CO2↑ H2O
(2) 通入足量的饱和NaHCO3溶液 SO2 2 NaHCO3 = Na2SO3 CO2↑ H2O
(3) 加入足量的NaOH溶液并过滤 SiO2 2NaOH = Na2SiO3 H2O
(4) 加入足量的NaOH溶液并过滤 Al2O3 2OH - = 2AlO2- H2O
 22、(1)铜片逐渐溶解,溶液逐渐变蓝,有气泡产生(3分);品红 22、(1)铜片逐渐溶解,溶液逐渐变蓝,有气泡产生(3分);品红
(或溴水)溶液逐渐褪色(1分)。图如右(3分)
(2)①C 2H2SO4(浓)==CO2↑ SO2↑ 2H2O(2分)
②(B)检验并除去SO2;
(C) 除去SO2,并检验是否除净
(D)检验CO2气体(各1分,共3分)
五、计算题 (23题11分, 24题4分, 共15分)
23、(1)32克 (2)18.4mol/L (3) 27ml
24、V(H2):V(O2) = 7:2 或 V(H2):V(O2) = 4:5
|