| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
二、 31.周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式 。 32.A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。 已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空: (1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称: (2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。 (3)A的正确选择有 种,其化学式为: 。 (4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数) 33.X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是 ,其中和产物的化学式是 。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是 。 三、实验题 34.(1)二氧化碳是共价化合物,它的电子式可表示为……………………。 (2)实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,产生的实验现象是……………………………………………………,相应的反应方程式为…………………………………………。 (3)在宇宙飞船和太空站上工作的宇航员,在密闭的工作舱内需要吸入氧气,呼出CO2,飞船内可以使用一种物质,它能吸收CO2,并产生氧气,该物质是………………………………………………,其反应方程式为…………………………………………………………。 35.实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法
| 实验过程中所发生反应的 化学方程式
| 实验所用仪器 (用编号表示)
| 实验需直接测定的有关物理量 (用文字说明)
| 1
|
|
|
| 2
|
|
| |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯
⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
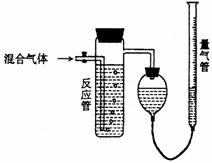 36.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
36.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四、计算题:
37.(8分)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00moL·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
答案:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B
BC
C
C
D
B
C
B
D
D
C
C
AB
B
B
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
A
B
C
B
C
C
C
A
B
A
A
C
A
A
AD
31.Na2O, K2S, MgF2, CaCl2
32.(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2)mA/MA=mB/MB+mC/MC(或MB<MA<MC;MC<MA<MB 以及其它合理答案)
(3)2种 Li2CO3 MgCO3 (4)MgCO3,BeCO3,Na2CO3 1.05
33.H2SO3,SO3,P2O5 Na3PO4、H2O 2P+5SO3=5SO2+P2O5
34.①略 ②产生白色沉淀(或白色混浊)。③Ca(OH)2+CO2=CaCO3↓+H2O ④Na2O2; ⑤2Na2O2+2CO2=2Na2CO3+O2↑(其他合理答案同样给分)
35.
实验方法
实验过程中所发生
反应的化学方程式
实验所用仪器
(用编号表示)
实验需直接测定的有关物理量
(用文字说明)
1
H2SO4+Zn→ZnSO4+H2↑
H2+CuO ![]() Cu+H2O
Cu+H2O
①②③⑦
实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量)
实验后Cu及硬质玻璃管的总质量
2
H2SO4+CuO→CuSO4+H2O
①⑤⑧⑨
过滤后剩余固体的质量
3
2Cu+O2 ![]() 2CuO
2CuO
①④⑥⑦⑧
实验前坩埚与样品总质量
(或坩埚质量)
实验后坩埚与CuO总质量
(以上三种方法任选两种,其它合理的方法也给分)
36.(1)N2、O2的体积 (2)偏低 (3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)bceg或beg或ceg
37.混合物中Na2SO4的质量= ![]() g·mol-1=1.42g
g·mol-1=1.42g
设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量= ![]() =0.0900mol 与Na2CO3、NaHCO3反应的盐酸的物质的量为
=0.0900mol 与Na2CO3、NaHCO3反应的盐酸的物质的量为
0.250L×1.00mol·L-1-0.500L×0.100mol·L-1×2+0.0100L×1.00 mol·L-1=0.160mol
![]()
解得:x=0.0700mol y=0.0200mol
Na2CO3质量=0.0700mol×106g·mol-1=7.42g
NaHCO3质量=0.0200mol×84g·mol-1=1.68g
| |