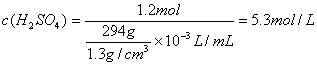|
物质的量检测卷
原子量 :H:1 C:12 O:16 N:14 P:31 S:32 Na:23 Fe:56 Cl:35.5
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个正确答案)
1、下列说法不正确的是 ( )
A. 物质的量就是物质的质量
B.摩尔是物质的量的单位
C.物质的量是以摩尔为单位计量粒子数目的物理量
D.物质的量和摩尔都是含有一定数目粒子的集体
2、下列有关摩尔质量的说法中正确的是 ( )
A.1molC的质量就是C的摩尔质量 B.12C的摩尔质量为12g
C.12g/mol就是M(12C) D.M(12C)与C在数值上相等
3、与98gH3PO4所含有的O数目相等的H2SO4是 ( )
A.98g B.49g C.1.5mol D.0.5mol
4、已知NaNO3溶液与Na2CO3溶液溶质质量分数相同;NaNO3、Na2CO3在水溶液里的电离方程式为:NaNO3=Na NO3- Na2CO3=2Na CO32-
这两种不同的溶液里与所含有的物质的量关系是 ( )
A.NO3-的较大 B.CO32-的较大 C.二者相等 D.无法比较大小
5.设NA表示阿伏加德罗常数的值。下列说法不正确的是 ( )
A. 1mol醋酸的质量与NA个醋酸分子质量相等
B. NA个氧分子和NA个氢分子的质量比等于16:1
C. 28g氮气所含的原子数目为NA
D. 1.7g氨气所含电子数目为NA
6. 下列说法中正确的是 ( )
A.1molO2和1molN2所占的体积都约是22.4L
B.H2的气体摩尔体积约为22.4L
C.在标准状况下,1molH2和1molH2O所占的体积都约为22.4L
D.在标准状况下,22.4L由N2,N2O组成的混合气体中所含有的N的物质的量约为2mol
7、已知空气的平均摩尔质量为29g/mol。在同温、同压下,某气体R对空气相对密度为2,该气体是 ( )
A.CH4 B.C2H4 C.C2H2 D.C4H10
8、在同温度、同体积和同质量的下列气体中,气体压强最小的是 ( )
A.CO2 B.CH4 C.H2 D.CO
9、在相同温度下,在体积相同的两个密闭容器内充入等质量CO2的SO2和气体,则下列说法中正确的是 ( )
A.CO2和SO2的物质的量相同
B.CO2和SO2的和密度比为11:16
C.CO2和SO2的压强比为16:11
D.CO2和SO2中所含氧原子的个数比为1:1
10、在标准状况下,vL氮气含有x个N2分子,则阿伏加德罗常数可表示为( )
A.vxmol-1 B.22.4xmol-1 C. 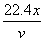 mol-1 D. mol-1 D. 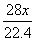 mol-1 mol-1
11、同温同压下,500ml气体R的质量是1.2g,1.5LO2的质量是2.4g,则R的相对分子质量 为 ( )
A.24 B.36 C.48 D.60
12、由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 ( )
A.29:8:13 B.22:1:14 C.13:8:29 D.26:13:57
13、有五瓶溶液分别是:(1)10ml0.6mol/LNaOH水溶液;(2)20ml0.50mol/LH2SO4水溶液;(3)30ml0.40mol/LHCl水溶液;(4)40ml0.30mol/LHAc水溶液;(5)50ml0.20mol/L蔗糖水溶液.以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A.(1)﹥(2)﹥(3)﹥(4)﹥(5) B.(2)﹥(1)﹥(3)﹥(4)﹥(5)
C.(2)﹥(3)﹥(4)﹥(1)﹥(5) D.(5)﹥(4)﹥(3)﹥(2)﹥(1)
14、溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合,混合溶液中H2SO4的质量分数 为 ( )
A.3a% B.6a% C.﹥3a% D.﹤3a%
15、已知氨水的密度为0.990g/cm3时,NH3的质量分数为2%,氨水的密度为0.930g/cm3时,NH3的质量分数为18%。溶质质量分数分别为a%和5a%的氨水按等体积混合,混合溶液中NH3的质量分数为 ( )
A.3a% B.6a% C.﹥3a% D.﹤3a%
16、VLFe2(SO4)3溶液中含agSO42-,取此溶液 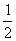 VL,用水稀释成2VL,则稀释后溶液的c(Fe3 ) 为 ( ) VL,用水稀释成2VL,则稀释后溶液的c(Fe3 ) 为 ( )
A. 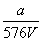 mol/L B. mol/L B. 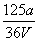 mol/L C. mol/L C. 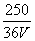 mol/L D. mol/L D. 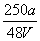 mol/L mol/L
17、用1000g溶剂中所含溶质的物质的量来表示的溶液的浓度叫做质量物质的量浓度,其单位是mol/kg,已知5mol/kg的硫酸溶液的密度为1.2894g/cm3,则此硫酸溶液的物质的量浓度 为 ( )
A.5.00mol/L B.5.25mol/L C.3.56mol/L D.4.33mol/L
18、100ml0.30mol/LNa2SO4溶液和50ml0.20mol/LAl2(SO4)3溶液混合后,在相同温度下溶液中SO42 的物质的量浓度为 ( )
A.0.20mol/L B.0.25mol/L C.0.40mol/L D.0.50mol/L
19、已知35%NaOH溶液的密度为1.38g/cm3,5%NaOH溶液的密度为1.05g/cm3,若将上述两溶液等体积混合,则所得NaOH溶液的质量分数是 ( )
A.大于20% B.等于20% C.小于20% D无法估算
20、20ml浓度为0.05mol/L的含Mn 溶液。恰好把15ml浓度为0.1mol/L的含S2-的溶液中的S2-离子全部沉淀,则n的值是 ( )
A.4 B.3 C.2 D.1
  答题卷 答题卷
二、填空题(本题共4小题,每空3分,共18分)
21、某2mol/L的阴离子RO4(n 1)-溶液20ml,恰好把30ml2mol/LBaCl2溶液中的Ba2 全部沉淀,则n等于_____,该沉淀的化学式为_________。
22、已知硫酸溶液的浓度越大密度也越大,40%的硫酸和50%的硫酸等质量混合后,所得溶液的质量分数______(大于、小于、等于)45%;若等体积混合,所得溶液的质量分数_______(大于、小于、等于)45%。
23、在Cu2O和CuO的混合物中,含Cu88%,则混合物中Cu2O和CuO的物质的量之比为___________。
24、已知在标准状况时,N2和O2的混合气体中,其体积比为4:1。则该气体的密度为________。
三、实验题(本题共1小题,共6分)
25、某学生配制1mol/LNaOH溶液100ml,进行以下操作,然后将此溶液精确测定,结果溶液浓度偏低。请从他操作中找出造成浓度偏低的原因:____________
(1) 天平空摆时,指针指向标尺左边。
(2) 托盘两边各放一张纸,称取NaOH直到天平达到平衡。
(3) NaOH倒入250ml烧杯中,加入少量蒸馏水,搅拌溶解冷却后转入100ml容量瓶中,烧杯未洗涤。
(4) 向容量瓶中加蒸馏水至刻度线。
(5) 塞上瓶塞,摇匀。
四、计算题(本题共2小题,每小题8分,共16分)
26、(8分)某盐酸的密度为1.05g/cm3,HCl的质量分数为10%。求
(1) 该盐酸的物质的量浓度为多少?
(2) 200ml该盐酸与过量的铁屑充分反应,生成H2的体积(标准状况)是多少?生成FeCl2的物质的量是多少?
27、(8分)有一块已部分被氧化为Fe2O3的铁片65.6g,跟密度为1.3g/cm3的硫酸溶液294g恰好完全反应,放出氢气13.44L(标准状况)(不考虑铁离子与铁之间发生的反应),问:
(1) 铁片中铁的纯度是多少?
(2) 铁片中Fe2O3为多少g?
(3) 这种硫酸的物质的量浓度是多少?
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个正确答案) |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
选项 |
|
|
|
|
|
|
|
|
|
| |
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 | |
选项 |
|
|
|
|
|
|
|
|
|
| | ![]()
![]()
![]()
![]()
![]()
![]() 2.9mol n(FeCl2) n(H2)
2.9mol n(FeCl2) n(H2)![]() V(H2)=0.29mol
V(H2)=0.29mol ![]()
![]()
![]()
![]()
![]()
![]()
![]() n
n