|
(时间:45分钟 满分:100分)
班级: 姓名: 学号:
本卷可能用到的相对原子质量:
H 1 C 12 N 14 O 16 S 32 Cl 35.5
一、选择题(每小题只有1个正确答案,各3分)
[1].加入HCl溶液后,溶液中哪种离子数目会减少( )
A.CO32- B.Al3 C.SO42- D.Mg2
[2].下列物质转化需要加入还原剂才能实现的是 ( )
A SO32-→SO2 B HCl→Cl2 C Na→Na+ D SO2→S
[3].下列各组离子能在呈酸性的无色溶液中大量共存的是 ( )
A Ba2+、Na+、NO3-、MnO4- B Mg2+、Cl-、Na+、SO42-
C K+、Cl-、HCO3-、NO3- D Ca2+、Na+、Fe3+、CO32-
[4].根据反应:2H2S+O2=2S↓+2H2O,4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,Na2S+I2=2NaI+S↓,判断下列物质的氧化性强弱,正确的是 ( )
A O2>I2>S B H2S>NaI>H2O
C S>I2>O2 D H2O>NaI>H2S
[5].下列反应既属于氧化还原反应,又属于吸热反应的是 ( )
A 铝片与稀盐酸反应 B Ba(OH)2·8H2O与NH4Cl的反应
C 灼热的碳与CO2的反应 D 甲烷在氧气中的燃烧反应
[6].下列有关氧化还原反应的叙述正确的是( )
A. 金属单质在反应中只作为还原剂
B. 金属原子失电子越多其还原性越强
C. Cu2+比Fe2+氧化性强而Fe比Cu还原性弱
D. 非金属单质在反应中只作为氧化剂
[7].下列反应中,反应前后元素的化合价没有变化的是( )
A. 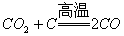
B. 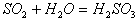
C. 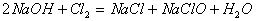
D. 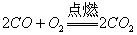
[8].向硫酸钡溶液中不断滴入硫酸溶液,其溶液的导电性的变化是( )
A. 由弱变强 B. 由强变弱
C. 由强变弱再变强 D. 由弱变强再变弱
9. 下列物质中,导电性最差的是( )
A. 熔融 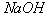 B. Na-K合金 B. Na-K合金
C. 盐酸溶液 D. 固态 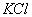
10. 离子 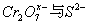 能在酸性溶液中发生如下反应: 能在酸性溶液中发生如下反应:
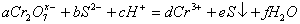 ( ( 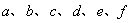 均为系数),若 均为系数),若 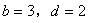 ,则 ,则  中 中 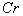 的化合价为( ) 的化合价为( )
A. 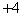 价 B. 价 B. 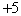 价 C. 价 C. 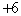 价 D. 价 D. 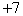 价 价
11. 下列反应中 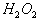 只作还原剂的是( ) 只作还原剂的是( )
A. 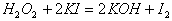
B. 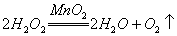
C. 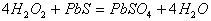
D. 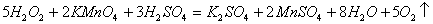
12. 在 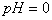 的无色透明溶液中,能大量共存的离子组是( ) 的无色透明溶液中,能大量共存的离子组是( )
A. 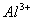 、 、 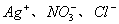 B. B. 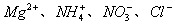
C. 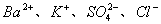 D. D. 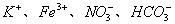
13. 能用 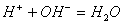 的离子方程式表示下列化学反应的是( ) 的离子方程式表示下列化学反应的是( )
A. 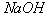 溶液和盐酸反应 B. 溶液和盐酸反应 B. 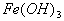 和硫酸反应 和硫酸反应
C. 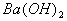 和醋酸反应 D. 和醋酸反应 D. 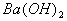 和硫酸反应 和硫酸反应
14. 下列物质中属于电解质的是( )
①NaOH ②BaSO4 ③Cu ④蔗糖 ⑤SO2
A. ①② B. ①②⑤ C. ③④ D. ①⑤
15. 只用一种试剂就能将 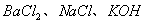 三种溶液区别开,此试剂是( ) 三种溶液区别开,此试剂是( )
A. 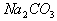 B. 盐酸 C. 硫酸 D. B. 盐酸 C. 硫酸 D.  溶液 溶液
已知反应X Y=M N 为放热反应,对该反应的下列说法中正确的是( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故一定不必加热就可发生
18、下列反应的离子方程式中,正确的是
A.大理石和盐酸:CO32—+2H+==H2O+CO2↑
B.铁和稀盐酸:2Fe+6H+==2Fe3++3H2↑
C.稀硫酸和氨水:H++NH3·H2O==NH4++H2O
D.碳酸氢钾溶液和盐酸:HCO3-+H+==H2O+CO2↑
二、方程式(52分)
22、用双线桥表示下列氧化还原反应,标出反应前后化合价升降情况和被氧化、被还原情况及电子转移的方向和数目
⑴ MnO2+4HCl(浓)==MnCl2+2H2O+Cl2↑
还原剂 还原产物
(2) 2K+2H2O==2KOH+H2↑
氧化剂 ,氧化产物
4. (4分)现有 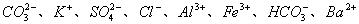 八种离子,请按要求填写: 八种离子,请按要求填写:
(1)只能与 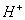 大量共存的有_________。 大量共存的有_________。
(2)只能与 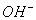 大量共存的有_________。 大量共存的有_________。
(3)既能与 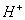 大量共存,又能与 大量共存,又能与 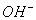 大量共存的有_________。 大量共存的有_________。
(4)既不能与 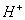 大量共存,又不能与 大量共存,又不能与 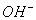 大量共存的有_________。 大量共存的有_________。
[9].(6分)写出下列离子方程式
(1)CO2使澄清石灰水变浑浊
(2)氨水(NH3·H2O)和醋酸(CH3COOH或HAc)混合
[10].(6分)写出下列离子方程式相应的化学方程式
(1)Al+3Ag+=Al3++3Ag
(2)CO32-+CO2+H2O=2HCO3-
[11].(40分)用双线桥分析下列氧化还原反应(写出得失电子数,化合价升降,被氧化被还原),并完成下列填空。
(1)C + 4HNO3(浓)  CO2↑ + 4NO2↑ + 2H2O CO2↑ + 4NO2↑ + 2H2O
氧化剂 ,还原剂 ,
12克碳参与反应可得到 克还原产物。
(2)3S + 6NaOH  2Na2S + Na2SO3 + 3H2O 2Na2S + Na2SO3 + 3H2O
被氧化的元素是 ,被还原的元素是 ,氧化产物 ,还原产物 ,氧化剂与还原剂的质量比是 ,该反应的离子方程式为:
(3)5NaCl + NaClO3 + 3H2SO4 = 3Cl2↑ + 3Na2SO4 + 3H2O
被氧化的物质是 ,被还原的物质是 ,氧化产物与还原产物的质量比是 ,该反应的离子方程式为:
(4)2KMnO4 + 16HCl = 2MnCl2 + 5Cl2↑ + 2KCl + 8H2O
被氧化的元素是 ,被还原的元素是 ,反应中被氧化的盐酸和未被氧化盐酸的质量比是 ,该反应的离子方程式为:
三、实验题(12分)
[12].现有失去标签的氯化镁,碳酸钠,硫酸,氢氧化钡四种无色溶液,为了确定四种溶液各是什么,将它们随意编号为A,B,C,D后,下表进行实验,产生的现象如下所示(氯化镁和碳酸钠反应生成的MgCO3是沉淀物质): |
反应编号 |
反应物质 |
有关现象 | |
① |
A+B |
有沉淀生成 | |
② |
B+C |
有气体放出 | |
③ |
C+D |
有沉淀生成 | |
④ |
B+D |
无明显现象 | |
⑤ |
A+D |
有沉淀生成 | |