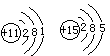|
1.元素的性质呈周期性变化的根本原因是
A.元素的原子量递增,量变引起质变 B.元素的原子半径呈周期性变化
C.元素的金属性和非金属性呈周期性变化 D.元素的原子核外电子排布呈周期性变化
2.下列元素中原子半径最大的是
A.Mg B.Al C.F D.Cl
3.粒子 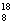 O和 O和  F的原子半径,前者和后者的关系是 F的原子半径,前者和后者的关系是
A.前者大 B.后者大 C.两者相等 D.不能肯定
4.在元素周期表中,主族元素IIA的硼到VIIA族的砹连一条斜线,即为金属和非金属分界线,从分界线附近可以可以找到
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
5.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
6.元素R的最高价含氧酸的化学式为HnRO2n—2,在它的气态氢化物中,R元素的化合价为
A.3n—4 B.3n—6 C.3n—12 D.2n—4
7.下列元素的最高价氧化物的水化物溶于水一定是强碱溶液的是
A.原子最外层只有一个电子的元素 B.原子次外层电子数是最外层电子数8倍的元素
C.原子次外层电子数是最外层电子数4倍的元素
D.原子的最外层电子数与电子层总数相同的元素
8.下列粒子半径大小比较正确的是
A. 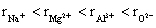 B. B. 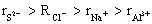
C. 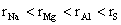 D. D. 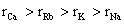
9.下列化合物中,阳离子半径与阴离了子半径比最小的是
A.NaF B.LiI C.CsF D.LiF
10.具有下列特征的原子,一定是非金属元素的是
A.对应氢氧化物是两性氢氧化物 B.具有负化合价
C.最高价氧化物对应的水化物是酸 D.具有可变化合价
11.A、B的同周期元素,如果A原子半径比B原子半径大,则下列说法中正确的是
A.两元素的最高价氧化物水化物酸性A强于B
B.两元素形成的气态氢化物的稳定性B比A稳定
C.A的阴离子的还原性比B的阴离子还原性强D.两元素A的原子序数大于B的原子序数
12.a元素的阳离子,b元素的阳离子和c元素的阴离子都具有相同的电子层结构,a的阳离子半径大于b的阳离子半径,则a, b, c三种元素原子序数大小顺序是
A.a < b < c B.b < c < a C.c < a < b D.b < a < c
13.下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是
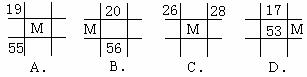
14.在元素周期表的前4周期中,图中排列着5种元素。若B元素的
核电荷数为z,则这5种元素核电荷数之和可能是
A.5z+2 B.5z+8 C.5z+10 D.5z+18
15.已知同周期的X、Y、Z三种元素的最高价氧化物水化物对应的酸性由强到弱的顺序是:HZO4 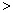 H2YO4 H2YO4 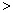 H3XO4,下列判断正确的是 H3XO4,下列判断正确的是
A.阴离子的还原性按X、Y、Z顺序减弱 B.单质的氧化性按X、Y、Z顺序增强
C.元素的原子半径按X、Y、Z顺序增大 D.气态氢化物的稳定性按X、Y、Z顺序减弱
16.在IIA族中,Be是惟一可以生成含氧酸根(铍酸根离子:BeO22-)的元素,与铍的性质相似的短周期元素是
A.Na B.Mg C.Al D.Si
17.A、B、C、D、E是电荷数依次增大的五种短周期族元素,原子半径按D、E、B、C、A顺序依次减少,B和E同主族,下列推断不正确的是
A.A、B、E一定不在同周期 B.A、D可能在同一主族
C.C的最高价氧化物对应的水化物可能显碱性D.C和D的单质可能化合形成离子化合物
18.两种短周期元素X、Y、可组成XY2型的化合物,则X、Y原子序数差不可能是
A.1 B.2 C.3 D.4
19.A为IIA族元素,B为IIIA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是
A.n=m+1 B.n=m+11 C.n=m+25 D.n=m+10
20.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A.x+2 B.x+4 C.x+8 D.x+18
21.X2、Y、Z2为三种元素的单质。已知有下列反应:
Cu+X2 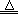 CuX2, 2Cu+Y CuX2, 2Cu+Y 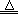 Cu2Y, 2KX+Z2 =2KZ+X2。 Cu2Y, 2KX+Z2 =2KZ+X2。
在Cu2Y中,Y为-2价。下列关于X、Y、Z三种元素的最高价氧化物对应的水化物的酸性强弱排列正确的是
A.HXO4 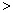 H2YO4 H2YO4 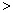 HZO4 B.HZO4 HZO4 B.HZO4 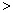 HXO4 HXO4 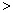 H2YO4 H2YO4
C.HZO4 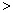 H2YO4 H2YO4 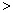 HXO4 D.H2YO4 HXO4 D.H2YO4 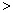 HZO4 HZO4 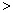 HXO4 HXO4
22.一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表第7周期第IV A族。由此,下列说法中正确的是
A.第7周期有50种元素 B.该原子的质量数是184
C.该元素相对原子质量是292 D.该原子核外有114个电子
23.据报道,1994年11月9日德国科学家利用亿个镍原子(28Ni)对数亿个铅原子(82Pb)连续轰击数天制得一种新原子 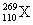 (暂用X表示),它属于一种新元素——第110号元素。这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒。经分析它属于过渡元素。下列关于该元素的叙述中正确的是 (暂用X表示),它属于一种新元素——第110号元素。这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒。经分析它属于过渡元素。下列关于该元素的叙述中正确的是
A.这种原子( 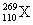 )的中子数为159 B.这种元素肯定是金属元素 )的中子数为159 B.这种元素肯定是金属元素
C.这种元素与铅(82Pb)属于同一族 D.这种元素属第6周期元素
24.无机化学命名委员会(国际组织)在1989年作出决定。把长式元素周期表原先的主、副族及族号取消,由左至右改为18列,如碱金属族为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是
A.该周期表第9列元素中没有非金属元素
B.第1列和第17列元素的单质熔、沸点变化趋势相反
C.只有第2列元素原子最外层有2个电子D.在第18列元素中,第3列的元素种类最多
25.已知硒是元素周期表中第四周期VIA族元素,关于硒的性质判断肯定不正确的是
A.硒的含氧化合物以Se2O3形式存在 B.硒的含氢化合物以H2Se形式存在
C.硒的氢化物的稳定性比硫化氢差 D.硒的最高价氧化物对应水化物的化学式是H2SeO4
26.试推断下列化合物的化学式:
(1)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是 或 ;若XY2是共价化合物,其化学式是
(2)第3周期内A、B两元素的原子序数之差为4。它们组成的化合物AB的化学式为
(3)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质化学式为
(4)某非金属X的最高正化合价为+m,它的最高正价氧化物对应的水化物形成的酸中有b个氧原子,则这种酸的化学式是 。
(5)X元素的最高正价和负价绝对值之差为6。Y元素和X元素原子的次外电子层上都有8个电子。X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子。则X和Y所形成的化合物是 。
27.A、B、C是周期表中相邻的三种元素,其中A、B同周期,B、C同主族。此三种元素原子最外层电子数之和为17,质子数总和为31。则A、B、C分别是 。
28.A、B、C、D是1-20号元素中的四种元素,A的最高正价与负价绝对值之差为6;A D次外层都是8个电子。A和D的化合物DA在水溶液中电离出相同电子层结构的阴、阳离子;B元素的原子有2个电子层,其元素的最高正价与最低负价的代数和为零;C2-离子与氩原子具有相同的电子层结构。上述各元素的元素符号是:A 、B 、C 、D
29.A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸则:
(1)A、B、C、D分别是 、 、 、 。
(2)A的离子结构示意图是 ,C的原子结构示意图是 。
(3)C的最高价氧化物对应的水化物与A的氢氧化物生成 种盐,其化学式为
(4)C、D的气态氢化物稳定性由强到弱的顺序是 。
30.有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族。 (1)写出元素符号:X ,Y ,Z ,W 。
(2)Z、W两元素最高价氧化物对应水化物的反应的方程式是 。
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 ,反应的化学方程式 。
31.X、Y、Z三种主族元素位于周期表中连续的三个不同周期。原子序数:Z 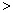 X X 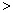 Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物对应的水化物是一种强酸。由此推出:X是 ,Y是 ,Z是 。将X的单质投入到Z单质的水溶液中,观察到的现象是 ,有关反应的化学方程式是 。 Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物对应的水化物是一种强酸。由此推出:X是 ,Y是 ,Z是 。将X的单质投入到Z单质的水溶液中,观察到的现象是 ,有关反应的化学方程式是 。
32.有A、B、C、D四种元素。常温下A的单质是暗红液体。B、C、D是短周期元素。D元素原子K层的电子数是B元素原子核外电子数的2倍。C、D元素原子最外电子层电子数相同,C元素原子核内质子数是D元素原子核内质子数的1/2
(1)各元素的符号是:A ,B ,C ,D 。
(2)由上述元素组成的一种单质和两种氧化物间可发生氧化还原反应,生成两种酸,其反应方程式是 。
34.今有下列两组单质,试将每组单质从三个不同角度进行“分类”。每种“分类”都可分别挑选出一种单质,它跟其他三种单质属于不同的“类”。将挑选出的单质(写化学符号)和挑选依据(写编码)列在下面相应的表格内。两组单质为:(I)O2、F2、S、N2(II)Fe、Na、Al、Si“挑选依据”仅限于以下六种:该被挑选出的单质跟其他三种单质不同,是由于:(A)其组成元素不属于周期表中的同一周期;(D)其组成元素不属于主族(或副族)元素;(E)在常温、常压下呈不同物态;(F)在常温下遇水能(或不能)放出气体。 |
组 别 |
|
第(I)组 |
|
|
第(II)组 |
| |
被挑选出的单质(写化学式) |
|
|
|
|
|
| |
挑选依据(写编码字母) |
|
|
|
|
|
| |