|
高一年级化学第一学期期末测试
说明:1.本卷满分100分,考试时间90分钟。
2.可能用到的数据:相对原子质量 H 1 C 12 N 14 O 16
Cl 35.5 Na 23 Mg 24 Mn 55
第Ⅰ卷(选择题48分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确
答案,请将选择的答案填到相应的答案栏中)
1.人们对于化学科学有各种各样的认识,其中错误的是
A.化学面对日益严重的环境问题显的无能为力,升学时考不考无关大局
B.化学是一门以实验为基础的自然科学,可以培养学生动手能力
C.化学是一门具有极强实用性的科学,应该予以重视
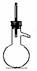 D.化学将在能源、资源的合理开发和安全应用方面大显身手 D.化学将在能源、资源的合理开发和安全应用方面大显身手
  2.下列仪器常用于物质分离的是 2.下列仪器常用于物质分离的是
   ① ② ③ ④ ⑤ ⑥ ① ② ③ ④ ⑤ ⑥
A.①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
3.最近中科院近代物理所有关专家在世界上首先发现了镤元素的一种新同位素 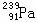 ,它的中子数为 ,它的中子数为
A.330 B.91 C.239 D.148
4.下列变化中,需加入还原剂的是 A.SO32-→SO2 B.S2-→S
C.CO2→H2CO3 D.CO2→CO
5.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是( )
①观察颜色;②石蕊试剂;③品红溶液
A ①②③ B 只有①③
C 只有②③ D 只有①②
6.用激光笔照射下列分散系,在侧面能看到一条光亮通路的是
A.CuSO4溶液 B.稀H2SO4
C.Fe(OH)3胶体 D.NaCl溶液
7.下列实验现象描述正确的是
A.干燥的氯气能使有色鲜花瓣褪色
B.铁丝在氯气中燃烧时冒出棕黄色的烟雾
C.过量新制的氯水滴到蓝色的石蕊试纸上,只能看到试纸变红
D.氢气在氯气中燃烧,火焰呈苍白色,同时冒出白烟
8.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律的摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
二、选择题(每小题有1个选项符合题意,每小题3分,共24分。)
9.除去镁粉中混有的少量铝粉,可选用的试剂是
A.盐酸 B.硫酸 C.氨水 D.氢氧化钾溶液
10.下列物质一般情况下不能用单质直接化合而制得的是
A.HCl B.NaCl C.FeCl2 D.CuCl2
11.某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是
A.Al3 、NO3ˉ、K 、SO42ˉ B.Ca2 、H 、HCO3ˉ、Na
C.OHˉ、CO32ˉ、Cu2 、SO42ˉ D.Fe3 、Mg2 、NO3ˉ、Clˉ
12.科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中错误的是
A.自然界中硅元素的储量丰富
B.自然界中存在大量的单质硅
C.高纯度的硅被用作计算机芯片
D.可用H2在高温下还原SiCl4的方法得到高纯硅
13.同为1L的NaCl溶液(浓度为c1)和Na2CO3溶液(浓度为c2),若其中的c(Na ) 物质的量浓度相同,则它们的物质的量浓度c1和c2的关系是
A.c1=2c2 B.不能确定 C.2c1 =c2 D.c1 <c2
14.在NO2与水的反应中,NO2的作用:
A.既是氧化剂又是还原剂 B.是氧化剂
C.是还原剂 D.既不是氧化剂又不是还原剂
|
☆ 修 正 液 ☆
(Correction)
【使用方法】
1.使用前摇匀修正液
2.涂于修正处少许
3.待完全干后书写
注意事项:
1.用完后请及时盖上帽子
2.严禁食用 |  15.右边的标签,是同学们经常使用的一种修正液的包装说明。某同学在仔细阅读后,结合自己的生活经验和所学知识,得出了修正液的某些性质的推测,请你分析他的结论中不合理的是 15.右边的标签,是同学们经常使用的一种修正液的包装说明。某同学在仔细阅读后,结合自己的生活经验和所学知识,得出了修正液的某些性质的推测,请你分析他的结论中不合理的是
A.修正液对纸张不具腐蚀性
B.修正液是一种胶体,均一、透明
C.修正液的溶剂易燃,严禁接触明火
D.修正液中不仅含有易挥发的物质、也含有毒的物质
16.下列离子方程式中,正确的是
A.稀硫酸与氢氧化钡液反应:Ba2 OH- H SO42-= BaSO4↓ H2O
B.铁与稀H2SO4反应:2Fe 6H = 2Fe3 3H2↑
C.在氯化镁溶液中加入澄清石灰水:Mg2 Ca(OH)2 = Mg(OH)2↓ Ca2
D.碳酸钙与盐酸反应:CaCO3 2H = Ca2 CO2↑ H2O
第Ⅱ卷(非选择题52分)
三、实验题(本项共2大题,共18分)
17.(8分) 选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液B.升华C.结晶D.分液 E.蒸馏 F.层 析 G.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
18.(10分)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成 。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成 。
写出甲装置中发生的主要反应的化学方程式 。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液或氢氧化钠溶液,写出棉花中发生的任一化学反应的离子方程式 。
(3)在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请你任写一种: 。四、填空题(本项共4大题,共27分)
19.(6分)下列三组物质中,均有一种物质的类别与其它三种不同
A.MgO、Na2O、CO2、CuO B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
⑴ 三种物质依次是(填化学式):A ;B ;C 。
⑵ 这三种物质相互作用可生成一种新物质,该反应 氧化还原反应(填“是”或“不是”)。
⑶ 写出这种新物质与足量盐酸反应的离子方程式:
________________________________________________________________________
20.(9分) = 1 \* GB2 \* MERGEFORMAT ⑴在标准状况下,物质 = 1 \* GB3 \* MERGEFORMAT ①4gH2, = 2 \* GB3 \* MERGEFORMAT ②33.6LCH4, = 3 \* GB3 \* MERGEFORMAT ③1molH2O,④3.01×1023个O2.含分子数最多的是(填序号,下同)__ __ __,含原子数最少的是___ ____,质量最大的是____ ___,体积最小的是_ ______。
= 2 \* GB2 \* MERGEFORMAT ⑵写出过氧化钠和水反应的化学方程式 ______
在此反应中,氧化剂是 ,还原剂是 ,每有1mol过氧化钠反应,则转移电子个数为_____________。
21.(6分)除去下列物质中所混有的少量杂质,写出有关的反应方程式。
(1)铜粉中混有少量铝粉 ;
(2) FeCl3中混有少量FeCl2 ;
(3)Na2CO3中混有少量NaHCO3 。
\* MERGEFORMAT 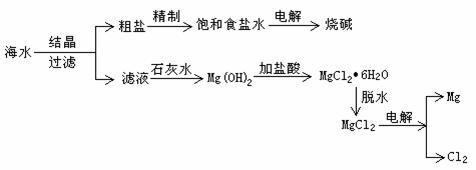 22.(6分)从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图: 22.(6分)从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
⑴ 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和 ,补填的玻璃仪器在过滤时,起到了 的作用。
⑵ 若粗盐中仅含有Ca2 、Mg2 两种杂质离子。精制提纯时,备用的除杂试剂有:
(A.盐酸 B.Na2CO3溶液 C.NaOH溶液) 请你正确排列加入的顺序:
( )、( )、( )(填编号)
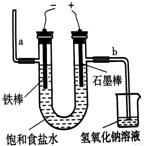 ⑶ 用右图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加紫色石蕊,溶液变 色。 ⑶ 用右图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加紫色石蕊,溶液变 色。
⑷ 在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为 (填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
五、计算题(本题共6分)
23. (6分) 向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,求原溶液中Fe3 的物质的量浓度。
涵江区2008—2009学年度第一学期期末高一年级测试
高一化学试卷参考答案(新课标·苏教版)
第Ⅰ卷 (选择题答题卡48分)
一、选择题(本题每小题3分,共24分,每小题只有一个正确答案) |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 | |
答案 |
A |
B |
D |
D |
A |
C |
A |
C | | ![]() Na2CO3 CO2↑ H2O (2′)
Na2CO3 CO2↑ H2O (2′)