|
气体摩尔体积
一、选择题
1.不同固态物质分子1mol,体积大小并不相同,主要原因是( )
A.微粒体积不同 B.微粒质量不同
C.微粒间平均距离不同 D.微粒间引力不同
2.在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是( )
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
3.下列说法正确的是( )
A.标准状况下22.4L就是气体摩尔体积
B.非标准状况下,1mol任何气体的体积不可能为22.4L
C.标准状况下22.4L任何气体都含有约6.02×1023个分子
D.1mol H2和O2的混合气体在标准状况下的体积约为22.4L
4.标准状况下的下列物质的体积是22.4L的有( )
A.40g NaOH B.6.02×1023个H2SO4 C.1mol H2O D.36.5g HCl
5.相同状况下,下列气体所占体积最大的是( )
A.80g SO3 B.16g O2 C.32g H2S D.3g H2
6.在标准状况下,100mL某气体的质量是0.125g,该气体的分子式可能是( )
A.NH3 B.CO C.H2S D、SO2
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
8.0.3mol O2 和0.2mol O3,它们的体积在同温同压下的比是( )
A.1:1 B.3:2 C.2:3 D.2:1
9.等物质的量的氢气和氦气在同温同压下具有相等的( )
A.原子数 B.体积 C.质子数 D.质量
10.两个体积相同的容器,一个盛一氧化氮,另一个盛氮气和氧气,在同温同压下两容器内的气体一定具有相同的:
A、原子总数 B、质子总数 C、分子总数 D、质量
11.下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H3PO4
A.①④③② B.④③②① C.②③④① D.①④③②
12.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.cba D.abcd
13.在0℃ 1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是( )
A.其密度之比等于物质的量之比 B.其密度之比等于摩尔质量之比
C.等质量的三种气体,其体积比等于相对分子质量的倒数比
D.等体积的三种气体,其物质的量之比等于相对分子质量之比
14.A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量为( )
A.m/n B.29m/n C.29mn D.29n/m
15. 同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
A.密度比为16:11 B.密度比为11:16
C.体积比为1:1 D.体积比为11:16
16.在标准状况下,m g 气体A与n g气体B的分子数相同,下列说法中不正确的是:
A、同质量气体A与B的分子个数比为m:n
B、同质量气体A与B的分子个数比为n:m
C、同温、同压下,A气体与B气体的密度比为n:m
D、相同状况下,同体积A气体与B气体质量比为m:n
17.24mL H2和O2的混合气体,在一定条件下点燃,反应后恢复至室温剩余3mL气体,则原混合气体中分子个数比为( )
A.1:16 B.16:1 C.17:7 D.7:5
18.同温同压下,某瓶充满O2时为116g,充满CO2时为122g,充满气体A时为114g,则A的式量为( )
A.60 B.32 C.44 D.28
19.在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则该化合物的化学式为( )
A.XY3 B.XY C.X3Y D.X2Y3
20.在标况下,10g CO和CO2的混和气体的体积为6.72L,则此混和气体中CO和CO2的物质的量之比是:
A.1:1 B.2:1 C.4:3 D.1:2
21.混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积比为( )
A.1:1 B.1:4 C.4:1 D.1:2
22.0.2g H2、8.8g CO2、5.6gCO组成的混合气体,其密度是相同条件下O2的密度的( )
A.0.913倍 B.1.852倍 C.0.873倍 D.1.631倍
23.1mol O2在放电条件下发生下列反应:3O2  2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( ) 2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
A.16 B.17.8 C.18.4 D.35.6
24.将20.8g两种金属的混合物投入足量的盐酸中,将反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A.钙和锌 B.镁和铜 C.铝和镁 D.锌和铁
25.将乙烯(C2H4),一氧化碳、氮气三种气体分别盛放在三个相同容器中,并保持三个容器内气体的温度和质量均相等,这三种气体对容器壁所施压强的大小关系是( )
A.C2H4>CO>N2 B.C2H4=CO=N2
C.CO>C2H4>N2 D.N2>C2H4>CO
26.在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数可近似表示为( )
A.22.4(m n) B.22.4×6.02×1023(m n)
C. 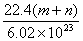 D.m n D.m n
27.二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,今用0.228g CS2在672mL O2(在标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是( )
A.448mL B.224mL C.336mL D.672mL
二、填空题
28.阿伏加德罗定律是指:“在相同的温度和压强下,相同体积的任何气体都 。由阿伏加德罗定律可以推导出:
(1)同温同压下:
a.同体积的两种气体的质量与式量关系为 。
b.两种气体的体积与物质的量关系为 。
c.两种气体等质量时,体积与式量关系为 。
d.两种气体密度与式量关系 。
(2)同温同体积时,不同压强的任何气体,与其物质的量的关系为 。
29.一种不纯的铁,已知它含有铜、铝、钙或镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质
是 。
30.A、B两种金属元素的相对原子质量之比是8:9,将这两种金属单质按物质的量之比为3:2组成1.26g混合物,跟足量稀H2SO4溶液反应,放也1.334L(标准状况)H2,若这两种金属单质在反应中生成H2的体积相等。则A的摩尔质量是 ,B的摩尔质量是 。
三、计算题
31.将126g NaHCO3加热到300℃,充分反应后,试计算残留固体的物质的量是多少?生成CO2气体的体积在标准状况下是多少?
32.把11体积的H2,5体积氧气和1体积氯气在密闭容器中用电火花点燃,恰好完全反应,所得溶液溶质的质量分数为多少?
33.一空瓶的质量为30.74g,充入干燥的氢气后质量为30.92g。在相同条件下,充入干燥的X2气体后,质量为37.13g。求X2气体的相对分子质量。
参考答案
一、选择题
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
A |
D |
CD |
D |
D |
B |
B |
B |
BC |
AC |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
A |
D |
BC |
C |
AD |
AC |
CD |
D |
A |
B |
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
B |
A |
B |
AB |
B |
A |
D |
|
|
|
二、填空题
28、含有相同数目的分子
(1)a 正比 b正比 c反比 d正比 (2) 正比
29、铜
30、24 g/mol 27 g/mol
三、计算题
31、0.75 mol 16.8 L
32、28.9%
33、71
|