|
化学反应及其能量变化综合能力测试题
【同步达纲练习】
一、选择题
1.下列反应中属于氧化还原反应的是( )
A.Cu2(OH)2CO3  2CuO H2O CO2 B.Na2O H2O = 2NaOH 2CuO H2O CO2 B.Na2O H2O = 2NaOH
C.2CO O2  2CO2 D.Na2CO3 CaCl2 = CaCO3 2NaCl 2CO2 D.Na2CO3 CaCl2 = CaCO3 2NaCl
2.氧化还原反应的实质是( )
A.分子中的原子重新组合 B.氧元素的得失
C.化合价的升降 D.电子的得失或共用电子对的偏移
3.下列物质既不是电解质,又不是非电解质的是( )
A.食盐水 B.H2O C.NaHSO4 D.Ca(OH)2
4.在1965年,我国科学工作者在世界上首次用化学方法人工合成了具有生物活性的物质是( )
A.血红素 B.叶绿素 C.核糖核酸 D.结晶胰岛素
5.下列变化中需加入氧化剂才能实现的是( )
A.Cl-→Cl2 B.Fe3 →Fe2 C.CuO→Cu D.H2SO4→BaSO4
6.下列说法中正确的是( )
A.干冰气化需吸收大量的热,这个变化是吸热反应
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应
D.用氢氧焰可以加热软化玻璃生产各种玻璃器皿,主要是利用了氢气和氧气化合时放出的热量
7.H-是负一价的阴离子,它可与NH3发生以下反应:H- NH3 = H2 NH2-,下列有关这个反应的说法中正确的是( )
A.它属于置换反应 B.该反应中H-是还原剂
C.该反应中NH3被氧化 D.反应中被氧化和被还原的元素都是H元素
8.下列离子方程式中,书写错误的是( )
A.碳酸钠溶液跟稀H2SO4混合: CO32- 2H = H2O CO2↑
B.硝酸铜溶液中滴加烧碱溶液:Cu2 2OH- = Cu(OH)2↓
C.醋酸溶液中加入氢氧化钾溶液:H OH- = H2O
D.MgSO4溶液中加入BaCl2溶液Ba2 SO42- = BaSO4↓
9.下列各组离子在溶液中不能大量共存的是( )
A.K 、SO42-、Cl-、Cu2 B.K 、Cl-、NO3-、Na
C.H 、SO42-、Cl-、CO32- D.Fe3 、Cl-、OH-、SO42-
10.按下列实验方法操作,能达到要求的是( )
A.用酸式滴定管量取11.40mL盐酸
B.用100mL量筒量取2.50mL稀盐酸
C.用托盘天平称量25.20gNaCl固体
D.用100mL容量瓶配制101.00mL一定浓度的盐酸溶液
11.电解质电离时一定相等的是( )
A.阴、阳离子数 B.阳离子和阴离子的质量
C.正电荷总数和负电荷总数 D.每个阳离子和阴离子所带电荷数
根据下列叙述,回答12~14题
某化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石;②用饱和Na2CO3溶液吸收步骤①中产生的CO2;③使步骤①中产生的CaO跟水反应;④消石灰跟Na2CO3溶液反应.
12.生产过程中没有涉及到的化学反应类型是( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
13.该厂生产过程中涉及的物质有:①煤②纯碱③小苏打(NaHCO3)④烧碱⑤二氧化碳⑥消石灰.下列叙述中正确的是( )
A.起始原料是①② B.起始原料是②⑥
C.最终产品是④⑤ D.最终产品是③④
14.该厂生产过程的优点可能有( )
①排放的气体对大气无污染.
②生产过程中的部分产品可作为起始原料使用.
③无高温作用
A.只有① B.只有② C.①和③ D.②和③
15.对溶液中的离子应有下列说法:①不可能是氧化还原反应.②只能是复分解反应③有可能是置换反应④不可能有分子参加,其中正确的是( )
A.①② B.只有③ C.②④ D.①④
16.在反应3Cu 8HNO3=3Cu(NO3)2 2NO 4H2O中当有19.2gCu参加反应时被还原的HNO3的质量为( )
A.50.4g B.19.2g C.51.2g D.12.6g
17.“酸雨”形成的主要原因是( )
A.森林遭到乱砍滥伐,破坏了生态平衡
B.工业燃烧大量含硫燃料
C.大气中CO2含量增多
D.汽车排出的大量尾气
二、填空题(共17分,共4个小题)
18.(7分)将碎蛋壳放到盛有食醋(含CH3COOH)的家用杯子中,会产生一种能使澄清石灰水变浑浊的无色气体,可推知蛋壳的化学成分中含有 .完成上述两个离子方程式: .如果给你少量澄清石灰水,你在家里如何操作可验证上述实验中产生的气体?简述操作过程: .
19.(4分)燃料充分烧烧的条件有 和 .
20.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填写编号).
(2)能够用以精确量取液体体积的是 (填写编号).
(3)在读取a、b、c仪器内液体的体积数时,俯视得到的数据比正确数据偏小的是_______ (填写编号).
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g.(北京市海淀区测试题)
21.一个体重50kg的健康人含Fe元素约2g.主要以Fe2 、Fe3 形式存在于人体内.Fe2 易被吸收,给贫血者补充铁时,应补充Fe2 的亚铁盐(如FeSO4)服用Vitc,可使食物中的Fe3 转化为Fe2 .
(1)人体中经常进行Fe2 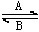 Fe3 的转化,在过程A中,Fe2 做 剂,过程B中Fe3 被 . Fe3 的转化,在过程A中,Fe2 做 剂,过程B中Fe3 被 .
(2)Vitc使Fe3 转化为Fe2 Vitc在这一过程中做 ,具有 性.
三、推断题 (共1个小题,9分)
22.X、Y、Z、M、N分别是常见的酸、碱、盐中的某种物质,已知X是含钠元素的化合物.它们之间有以下反应关系:
(1)2X Y=Z 2H2O (2)Z M=BaSO4 2X (3)M CuSO4=BaSO4 N
根据上述反应
①推断各物质的化学式为:X Y Z M
N
②完成上述反应的离子方程式:(1) (2) (3)
23.(7分) 现有KBr和KCl的混合物3.87g,溶于水并加入过量的AgNO3溶液后,产生6.63g沉淀(AgBr和AgCl的混合物),试计算原混合物中含钾元素的质量分数.
24.(6分)某种钙盐溶液280g与207g可溶性K2CO3溶液恰好完全反应,生成沉淀15g,试计算原K2CO3溶液中K2CO3的质量分数.
参考答案
【同步达纲练习】
一、1.C 2.D 3.A 4.D 5.A 6.BD 7.BD 8.C 9.CD 10.A 11.C 12.C 13.AD 14.B 15.B 16.D 17.BD
二、18.CaCO3;CaCO3 2CH3COOH=Ca2 2CH3COO- H2O CO2↑;
CO2 Ca2 2OH-=CaCO3↓ H2O;取玻玻璃片,涂上石灰水罩在反应的杯子上,有浑浊生成即是.
19.有足够的空气;和空气有足够大的接触面
20.(1)a,b,c (2)c (3)c (4)9.5
21.(1)还原剂,氧化 (2)还原剂,还原
22.①X:NaOH Y H2SO4 Z Na2SO4
M Ba(OH)2 N Cu(OH)2
②(1)OH- H =H2O (2)Ba2 SO42-=BaSO4↓ (3)Ba2 2OH- Ca2 SO42-=BaSO4↓ Cu(OH)2↓
23.40.3%
提示:反应过程中, 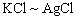

两个反应有共同点,就是质量的变化是类似,抓住这一点

可以直接求出K元素质量。
24.10%
|