|
高一年级化学上学期期末考试卷(苏教版必修1专题1—3)
(考试时间:90分钟;满分:100分)
说明:
1、本卷分第I卷(选择题)和第II卷(非选择题)两个部分。
2、可能用到的原子量:H—1 C—12 N—14 O—16 Mg—24 Al—27 S—32 Cl—35.5 K—39 Fe—56 Cu—64 Ba—137
第I卷(选择题,共46分)
一、选择题(本题含8小题,每小题2分,共16分。每小题只有一个选项符合题意)
1.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主
要用于制作窗框、 卷帘门等。下列性质与这些用途无关的是( )
A、强度高 B、不易生锈 C、密度小 D、导电、导热性好
2.下列物质的工业制法不正确的是( )
A、电解熔融氧化铝制取金属铝 B、用一氧化碳还原铁矿石炼铁
C、电解饱和食盐水制取金属钠 D、从海产品中提取碘
3. 原子结构模型的演变图中,⑴为道尔顿实心球式原子模型、⑵为卢瑟福行星运转式原子模型、⑶为汤姆生葡萄干面包式原子模型、⑷为近代量子力学原子模型、⑸为玻尔轨道式原子模型。其中符合历史演变顺序的一组排www.ks5u.com列是( )
A.⑴⑶⑵⑸⑷ B.⑴⑵⑶⑷⑸ C.⑴⑸⑶⑵⑷ D.⑴⑶⑸⑷⑵
4.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
|
|
分类 |
名称(或俗名) |
化学式 |
|
A |
碱性氧化物 |
氧化铁 |
FeO |
|
B |
酸性氧化物 |
碳酸气 |
CO |
|
C |
酸 |
硫酸 |
H2S |
|
D |
盐 |
纯碱 |
Na2CO3 |
5.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
6.利用下列实验装置完成相应的实验,能达到实验目的的是( )
 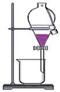 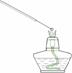
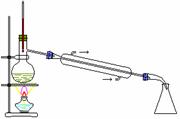 A.检验溶液中是否含有NaCl B.除去乙醇中溶有的少量水 A.检验溶液中是否含有NaCl B.除去乙醇中溶有的少量水
C.实验室中制取少量蒸馏水 D.实验室制取并收集氧气
7.下列四组实验,根据实验事实得出的结论,正确的是( )
A.在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解——原未知试液中一定含有SO42-
B.某未知气体在空气中燃烧,其产物能使无水CuSO4变蓝色——原气体一
定是H2
C.在某未知试液中滴加盐酸产生无色气体,将该气体通入足量澄清石灰水中得白色沉淀——原未知试液中一定含有CO32-
D.在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体——原未知试液中一定含有NH4
8.在实验室中,对下列事故或药品的处理正确的是( )
A、漂白粉长期放置在烧杯中
B、金属钠着火燃烧时,不能用泡沫灭火器灭火,应该用沙子灭火
C、氯水可以用无色透明的试剂瓶盛装保存
D、有大量的氯气泄漏时,用氢氧化钠溶液浸湿软布蒙面,并迅速离开现场
二、选择题(本题含10小题,每小题3分,共30分。每小题只有一个选项符合题意)
9.V L Al2 (SO4)3溶液中含a g Al3 ,从中取出 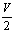 L,并稀释至V L,则稀释后SO42—的物质的量浓度为( ) L,并稀释至V L,则稀释后SO42—的物质的量浓度为( )
A. 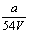 mol·L—1 B. mol·L—1 B. 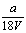 mol·L—1 C. mol·L—1 C. 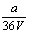 mol·L—1 D. mol·L—1 D. 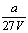 mol·L—1 mol·L—1
10.设NA为阿伏加德罗常数,下列叙述正确的是( )
A.18g 21H218O中所含的电子数为8NA
B.标准状况下,11.2L氯气和氢气的混合物中所含的分子数为NA
C.等质量的氧气和臭氧所含的氧原子数比为2:3
D.4.6gNa与50mL1mol/L硫酸反应失去的电子数为0.2NA
11.下列离子方程式的书写正确的是 ( )
A、Cl2和澄清石灰水反应:Cl2 2OH-= Cl- ClO- H2O
B、NaHCO3溶液与NaOH溶液反应: OH- HCO3- = CO2↑ H2O
C、向AlCl3溶液中加入过量的氨水:Al3 3OH- = Al(OH)3↓
D、实验室用大理石和稀醋酸制取CO2: CaCO3 2H =Ca 2 CO2↑ H2O
12.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )
.... ①NaHCO3 ②Al ③(NH4)2CO3 ④Al(OH)3 ⑤BaCl2
A.③④⑤ B.②③④⑤ C.①②③④ D.全部
13.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Mg2+、Ba2+、Cl-、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A.100 mL溶液中含0.01 mol CO32 - B.K+一定存在
C.Ba2+一定不存在,Mg2+可能存在 D.Cl-一定存在
14.在硫酸铁溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是( )
A.残余固体全部是铜 B.残余固体可能是铁和铜的混合物
C.残余固体是铁,溶液中一定不含Cu2 D.最后得到的溶液可能含有Fe3
15.在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液: Na 、Cl-、SO42-、Fe3
B.使紫色石蕊试液变红的溶液:Fe2 、Mg2 、ClO-、Cl-
C. pH<7的溶液:K 、Ba2 、Cl-、Br-
D.碳酸氢钠溶液:K 、SO42-、Cl-、H
16.纯碱和小苏打是厨房中两种常见用品,它们都是白色固体,下列区分它们的说法正确的是( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生
气泡速率较快的是小苏打
C.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化
的是小苏打
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
17.下列关于氧化还原反应的说法错误的是( )
① NaH H2O = NaOH H2↑的反应中NaH是还原剂,H2O是氧化剂
② 反应3NO2 H2O = 2HNO3 NO中氧化剂、还原剂的物质的量比为2:1
③ MnO2 4HCl ==== MnCl2 Cl2↑ 2H2O的反应中盐酸只起还原作用
④ 2Al 2NaOH 2H2O=2NaAlO2 3H2↑的反应中Al是还原剂, H2是还原产物
⑤ 5NH4NO3=4N2↑ 2HNO3 9H2O的反应中,氧化产物和还原产物物质的量比
为3:5
A.①②③④⑤ B.②④⑤ C.①②③⑤ D.②③⑤
18、镁粉加入到很稀的硝酸中发生反应:
4Mg 10HNO3=4Mg(NO3)2 NH4NO3 3H2O
在该反应中被还原的硝酸和未被还原的硝酸的物质的量比为( )
A.4:10 B.1:9 C.1:5 D.1:7
第Ⅱ卷(非选择题,共54分)
三、填空题(本题共2小题,共16分)
19.(1)(3分)在标准状况下,44.8L的NH3气体质量为 g,其中含 个氢原子,其中含 mol N。
(2) (3分)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是 ,等质量的NH3与H2R的物质的量比为 ,1.7g氨气与 mol H2O含有的电子数相等。
(3)(4分)过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2 2CO2 = 2Na2CO3 O2 ; Na2O2 2CO = Na2CO3
试分别写出Na2O2与SO2、SO3反应的化学方程式:
20.(6分)禽流感病毒是一种没有超常抵抗力的病毒。研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将禽流感病毒杀灭。氯气与氢氧化钙充分反应,使次氯酸钙成为主要成分,  得到漂粉精,其稳定性比漂白粉高。 得到漂粉精,其稳定性比漂白粉高。
将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为 。另取少许上层清液,先滴加适量的 (填化学式)酸化,再滴加 (填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为 。
四、实验题(本题2小题,19分)
21.(6分)除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关反应的离子方程式。
|
|
试剂 |
离子方程式 |
|
⑴镁粉中混有少量铝粉 |
|
|
|
⑵FeCl3溶液中混有少量FeCl2 |
|
|
22.(13分)食盐是日常生活的必需品,也是重要的化工原料。
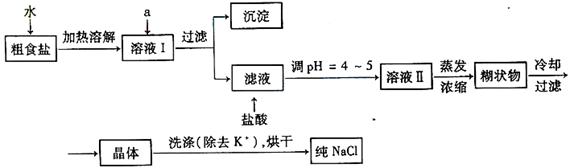 ⑴粗食盐常含有少量K 、Ca2 、Mg2 、Fe3 、SO42-等杂质离子,实验室提纯NaCl的流程如下: ⑴粗食盐常含有少量K 、Ca2 、Mg2 、Fe3 、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 四氯化碳
欲除去溶液Ⅰ中的Ca2 、Mg2 、Fe3 、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 。(只填化学式)
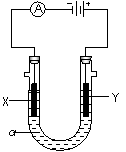 ⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有 ⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
⑶电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后 (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式 。
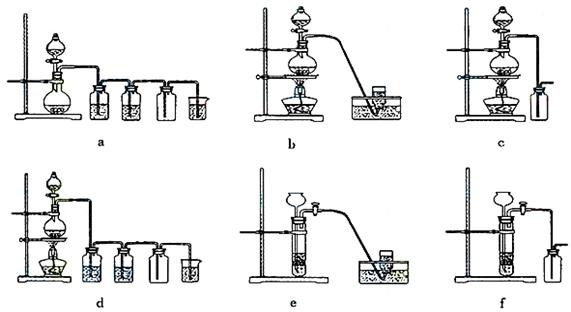
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
 五. 推断题 (本题共1小题,共10分) 五. 推断题 (本题共1小题,共10分)
23.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
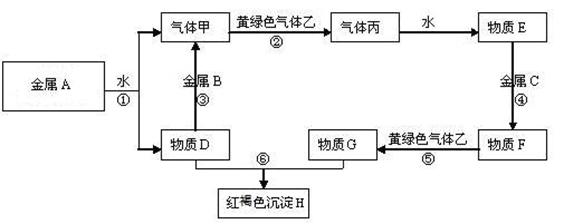
请根据以上信息回答下列问题:
⑴写出下列物质的化学式:
A 、 B 、 C 、
F 、 H 、乙
⑵写出下列反应离子方程式:
反应①
反应⑥
六、计算题(本题共1题,共9分)
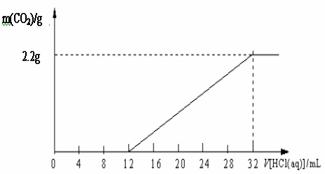 24.某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到下图所示的曲线。 24.某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到下图所示的曲线。
(1)写出所发生反应的化学方程式:
、
试计算:
(2)混合物中碳元素的质量分数(保留两位小数)。
(3)确定各成分的质量分别是多少?
2008-2009南安一中高一年上学期期末考化学试卷
(苏教版必修1专题1—3) 参考答案
选择题(1-8每小题2分,9-18每小题3分,共46分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
答案 |
D |
C |
A |
D |
B |
C |
D |
B |
|
|
|
题号 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
C |
D |
A |
C |
B |
A |
C |
B |
D |
B |
三、填空题(本题共2小题,共16分)
19、(10分)(1)34;6NA或6×6.02×1023;2 (各1分)
(2)34g/ mol; 2:1; 0.1 (各1分)
(3)Na2O2 SO2 = Na2SO4 ; 2 Na2O2 2SO3 = 2Na2SO4 O2↑(各2分)
20、(6分) Ca2+ + CO32- = CaCO3 ↓(2分); HNO3(1分) AgNO3(1分)
Ag+ + Cl- = AgCl↓ (2分)
四、实验题(本题2小题,19分)
21、(6分) (1) NaOH溶液(1分),2Al 2OH— 2H2O = 2AlO2— 3H2↑(2分)
(2) 通入Cl2(1分), 2Fe2 Cl2 =2Fe3 2Cl— (2分)
22、(13分)(1)NaOH、BaCl2、Na2CO3或(BaCl2、NaOH、Na2CO3) (2分)
(错选、多选不给分、NaOH溶液的加入顺序及是否答NaOH溶液不影响得分)
(2)天平、烧杯、500mL容量瓶,胶头滴管(4分)(少一个扣1分;写错1个扣1分,扣完
为止)
(3) X (1分) 2NaCl 2H2O ===== 2NaOH H2↑ Cl2↑ (2分)
(4) e (2分) d (2分)
五. 推断题 (本题共1小题,共10分)
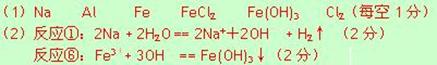 23、 23、
六、计算题(本题共1题,9分)
24.(1) K2CO3 HCl = KCl KHCO3;KHCO3 HCl = KCl H2O CO2↑(4分)
(2)9.77% (2分) (3)碳酸钾41.4g 碳酸氢钾20g(3分)
|