|
考试时间:90分钟 试卷满分:150分
可能用到的相对原子质量: H—1 O—16 C—12 N—14 S—32 Cl—35.5 Na—23 Mg—24 Fe—56 Al—27 Cu—64 Ca—40
第Ⅰ卷 (共100分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共60分)
1.放射性同位素  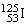 可用于治疗肿瘤。该同位素原子核内的中子数是 可用于治疗肿瘤。该同位素原子核内的中子数是
A.19 B.72 C.53 D.125
2.下列物质中属于强电解质的是
A.SO2 B.Na2SO4 C.Cl2 D.CH3COOH
3.除去氯气中混有的氯化氢气体,常采用的方法是将混合气体:
A.通过氢氧化钠溶液 B.通过澄清石灰水
C.通过浓硫酸 D.通过饱和食盐水
4.常温下,将一小块铝片投入足量的下列溶液中,铝片不能全部溶解的是
A.浓硫酸 B.稀硫酸
C.氢氧化钠溶液 D.稀盐酸
5.为除去FeSO4溶液中的Fe2(SO4)3,最好选用
A.氯水 B.氢氧化钠溶液 C.铜粉 D.铁粉
6.下列物质中,不能与氢氧化钠溶液发生反应的是
A.Fe B.Al2O3 C.NaHCO3 D.SiO2
7.不能用来萃取碘水中的碘的物质是
A.汽油 B.苯(不溶于水) C.酒精 D.四氯化碳
8.实验室保存下列物质的方法中,不正确的是
A.少量金属钠保存在煤油里
B.烧碱溶液盛装在用玻璃塞塞紧的试剂瓶中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.氯水应装在棕色瓶中密封避光保存
9.现有MgCl2、AlCl3、FeCl3、NH4Cl四种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是
A.氨水 B.AgNO3
C.NaOH溶液 D.NaCl溶液
10.下列变化中,需加氧化剂才能实现的是
A.NaClO → NaCl B.FeCl3 → FeCl2
C.C → CO2 D.CaO→ Ca(OH)2
11.关于钠元素,下列叙述中不正确的是
A.钠离子与钠原子有相同的质子数
B.钠原子易失一个电子,表现强氧化性
C.不同条件下,钠单质与氧气反应可生成不同的氧化物
D.自然界中钠元素只以化合态存在
12.下列实验现象的描述错误的是
A.久置的氯水能使有色布条褪色
B.向石蕊试液中加入新制氯水,石蕊试液先变红后褪色
C.向淀粉KI溶液中滴加新制氯水,溶液变蓝色
D.在新制氯水和久置氯水中滴加AgNO3溶液都有白色沉淀生成
13.下列化学反应的离子方程式书写正确的是
A.钠与水反应:Na 2H2O=Na 2OH- H2↑
B.FeCl3溶液与Cu粉反应:Cu Fe3 ==Cu2 Fe2
C.氯气与水反应:Cl2 H2O  2H Cl— ClO— 2H Cl— ClO—
D.氯化铝溶液与过量氨水反应:3NH3•H2O Al3 =Al(OH)3↓ 3NH4
14.将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是
A.Fe B.Fe2O3 C.FeCl3 D.Fe(OH)3
15.下列各组离子,能在溶液中大量共存的是
A.NH4 、Cl—、 K 、SO42— B.Fe3 、Na 、OH—、NO3—
C.Ag 、Na 、Cl—、NO3— D.H 、Na 、NO3—、CO32—
16.检验烧碱中是否混有纯碱的方法是
A.灼烧,看火焰是否为黄色 B.滴加盐酸,看是否有气体产生
C.溶解后测定溶液是否为碱性 D.加热,看是否有气体生成
17.点燃的镁条伸入盛有下列气体的集气瓶中,镁条不能继续燃烧的是
A.氧气 B.氮气 C.水蒸气 D.CO2
18.在Cl2 2NaOH = NaCl NaClO H2O的反应中,有关说法错误的是
A.Cl2既是氧化剂又是还原剂
B.NaOH既是氧化剂又是还原剂
C.该反应可用于实验室制Cl2时尾气的吸收
D.该反应的离子方程式为Cl2 2OH— ==== Cl— ClO— H2O
19.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁。下列说法中错误的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.以上提取镁的过程中涉及的反应均不是氧化还原反应
20.等物质的量的下列金属分别跟足量盐酸反应,同温同压下产生氢气体积最大的是
A.钠 B.铝 C.镁 D.铁
二、填空题(共40分)
21.(12分)请按要求回答下列问题:
(1)铝热反应在工业生产中的重要用途之一是 ;“ 硅材料”又被称为信息材料,其中广泛用于光导纤维的材料是(填化学式,下同) ,作为半导体材料广泛用于制造集成电路的是 。
(2)氯气是一种重要的化工原料,工业上用电解饱和食盐水制氯气,写出该反应的化学方程式 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是(用化学方程式表示) 。
22.(12分)在下列提供的试剂中,选择合适的试剂除去下表中各混合物的杂质(括号内物质为杂质),并按要求填写空格。
A.NaOH溶液 B.氨水 C.稀硫酸 D.稀盐酸 E.氯水 F.溴水
|
混合物(括号内为杂质) |
除杂试剂(填序号) |
反 应 离 子 方 程 式 |
|
①SiO2(CaCO3) |
|
|
|
②Mg(Al) |
|
|
|
③ NaBr(NaI) |
|
|
23.(16分)已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液呈酸性;D为银白色金属单质,E为浅绿色溶液。它们之间有下列转化关系:

(1)试写出A、B、D、E的化学式:
A_________;B_________;D____________;E________。
(2)写出A与B反应的化学方程式: ;
(3)若往E溶液中加入NaOH溶液,并露置于空气中一段时间,可观察到的现象是 ;
(4)E A反应的离子方程式: ;
F D反应的离子方程式: 。
第Ⅱ卷(共50分)
注意:将第Ⅱ卷的选择题答案按照题号正确添涂在机答卡上
三、选择题(每小题只有一个选项符合题意,每小题3分,共18分)
24.设阿伏加德常数为NA,则下列说法正确的是
A.5.6 g 铁在足量氯气中燃烧,电子转移0.2 NA个
B.1.12 L氯气中含有0.1 NA个氯原子
C.标准状况下,22.4L的溴单质含NA个溴分子
D.常温常压下,1L 0.1mol/L MgCl2溶液中含Cl—离子数为0.2NA
25.向含有NaBr和NaI的混合溶液中通入过量氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是
A.NaCl和NaI B.NaCl和I2
C.NaCl和NaBr D.NaCl
26.在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A.Cu2 和Fe2 B.H
C.Fe2 D.Fe3 和Cu2
27.关于物质的工业制备,下列说法正确的是
A.工业用电解氯化钠溶液法制取金属钠
B.工业提取铝是把铝土矿中的氧化铝提纯后采用加热分解法制备单质铝
C.工业采用高炉法炼铁
D.工业制玻璃的原料为黏土和石灰石
28.小华家中有如下生活用品:碘酒、食盐、食醋、漂白粉,小华利用上述用品不能完成的任务是
A.检验买来的奶粉中是否加有淀粉
B.检验自来水中是否含有Cl—
C.除去保温瓶中的水垢[主要成份为Mg(OH)2和CaCO3]
D.洗去白色衣服上的红色番茄汁
29.200mL 1mol•L—1的氯化铝溶液中加入一定体积的2mol•L—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A.只有① B.①③ C.②④ D.②③
四、填空与计算(共32分)
30.(12分)过量铁粉与稀硝酸反应的方程式为:
3Fe 8HNO3 (稀)== 3Fe(NO3)2 2NO↑ 4H2O,
①标出电子转移的方向和数目
②该反应的氧化剂是 ,还原产物是 ;
③标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移电子的物质的量为 ,有 mol氧化剂被还原。
31.(20分)下图是两个实验装置(铁架台等辅助仪器略去未画)
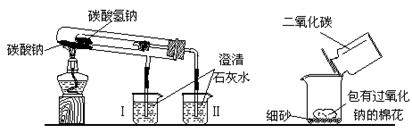
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是 (填“Ⅰ”、“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是: ,通过实验甲可比较出Na2CO3、NaHCO3两种固体, 更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧。写出Na2O2与CO2的反应化学方程式 ,棉花能燃烧说明该反应特点是 。
(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。求:(要求写出计算过程)
①生成的CO2气体体积(标准状况下) ②原混合物中碳酸钠的质量分数。
福州八中2008—2009学年第一学期期末考试
高一化学 必修Ⅰ 参考答案及评分标准
第Ⅰ卷(共100分)
一、选择题(每题3分,共60分) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
B |
B |
D |
A |
D |
A |
C |
B |
C |
C | |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 | |
B |
A |
D |
A |
A |
B |
C |
B |
D |
B | |