|
化学反应及其能量变化检测题
464193 河南省信阳市第十一高级中学 杨超 0376--6813504
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意。)
1、区别强弱电解质的根本标准
A、电离程度 B、化学键类型 C、物质的状态 D、溶液导电能力
2、演示铁在纯氧中燃烧实验时,将铁丝绕成螺旋状,其主要目的是
A、提高铁丝利用率 B、增大反应的接触面积 C、提高反应的温度 D、使瓶底氧气充分利用
3、下列反应既是氧化还原反应,又是吸热反应的是
A、铝片与稀硫酸反应 B、Ba(OH)2·8H2O与NH4Cl的反应
C、灼热的碳与CO2反应 D、甲烷在O2中的燃烧
4、下列离子方程式书写不正确的是
A、小苏打溶于醋酸溶液:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
B、碳酸氢钙与盐酸反应:Ca(HCO3)2+H+=Ca2++H2O+CO2↑
C、硫酸氢钠与氯化钡溶液的反应:Ba2++SO42-=BaSO4↓
D、向碳酸钠溶液中滴加少量稀盐酸:CO32-+2H+=HCO3-
5、M2O7x-离子和S2- 在酸性溶液中发生如下反应:M2O7x- 3S2- 14H == 2M3 3S↓ 7H2O 则M2O7x-离子中M的化合价是
A、 2 B、 3 C、 4 D、 6
6、今有下列三个氧化还原反应:①2FeCl3 2KI == 2FeCl2 2KCl I2②2FeCl2 Cl2 == 2FeCl3③2KMnO4 16HCl == 2KCl 2MnCl2 8H2O 5Cl2↑若某溶液中有Fe2 、Cl-和I - 共存,要氧化除去I- 而又不影响Fe2 和Cl-,可加入的试剂是
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
7、在无色透明的酸性溶液中能大量共存的离子组
A、MnO4- Cl- K SO42- B、Ag NO3- K Cl-
C、S2- Na SO42- K D、Mg2 NO3- Cl- K
8、在Fe、AgNO3(溶液)、盐酸、Ba(OH)2(溶液)、Na2SO4(溶液)、Na2CO3(溶液)六种物质中能发生离子反应的个数和氧化还原反应的个数为
A、6、1 B、8、1 C、9、2 D、10、2
9、下列反应属于离子反应、同时又有颜色变化的氧化还原反应是
A、氧化铜边通氢气边加热 B、氯化钡溶液和硫酸溶液混合
C、把铜片放入硝酸汞溶液中 D、氯化铁溶液与氢氧化钠溶液反应
10、根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后,Na2SO3转化为
A、Na2SO4 B、SO2 C、S D、Na2S
11、化学反应PbO CO====Pb CO2属于
A、置换反应 B、氧化还原反应 C、复分解反应 D、分解反应
12、在一定条件下,氯酸钾和的碘按下式发生反应,2KClO3 I2 == 2KIO3 Cl2 ,由此可推断下列相应的结论中,不正确的是
A、该反应属于置换反应 B、还原性:I2>Cl2
C、非金属性:I2>Cl2 D、氧化性:KClO3 >I2
13、下列叙述正确的是
A、在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B、没有单质参加的反应一定不是氧化还原反应
C、置换反应一定是氧化还原反应
D、使电子难的原子,容易获得的电子
14、G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):①G 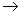 Q NaCl ②Q H2O Q NaCl ②Q H2O 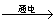 X H2 ③Y NaOH X H2 ③Y NaOH 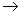 G Q H2O④Z NaOH G Q H2O④Z NaOH 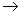 Q X H2O这五种化合物中氯的化合价由低到高的顺序为 Q X H2O这五种化合物中氯的化合价由低到高的顺序为
A、QGZYX B、GYQZX C、GYZQX D、ZXGYQ
15、在反应3S 6KOH  K2SO3 2K2S 3H2O 中,被氧化的与被还原的硫原子数之比为 K2SO3 2K2S 3H2O 中,被氧化的与被还原的硫原子数之比为
A、1︰2 B、2︰1 C、1︰1 D、3︰2
二、填空题(本题包括4小题,3 7 10 11,共30分)
16、已知NaOH稀溶液与稀H2SO4反应生成18g H2O放出57.3KJ 的热,Ba(OH)2溶液与稀H2SO4反应同样生成18g H2O,放出的热 (填“<”、“>”或“=”=57.3KJ 。
17、已知铜在常温下能被稀HNO3溶解,反应为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑十4H2O。
(1) 请将上述反应改写成离子方程式: 。
(2) HNO3没有全部参加氧化还原反应,没有参加氧化还原的硝酸占总硝酸的 。若反应中每生成1个NO,则反应中转移 个 e-。
18、已知4℃时四种化合物在水中和液氨中的溶解度如下:
AgNO3 Ba(NO3)2 AgCl BaCl2
H2O(液) 170g 9.2g 1.5×10 – 4 g 33.3g
NH3(液) 86g 97.2g 0.8g 0g
上述四种物质在液氨中发生的复分解反应的化学方程式为: ,在水中发生的复分解反应的离子方程式为: 。
19、某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K 、Ag 、Fe3 、Cl - 、OH - 、NO3- 六种离子。
(1)甲厂的废水明显呈碱性,则甲厂废水中所含的三种离子是 。
(2)乙厂的废水中含有另外三种离子。如果加一定的(从活性炭、硫酸亚铁、铁粉中选一种试剂)
,可以回收金属 (填化学式)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的
离子转化为沉淀,经过滤后的废水主要含有 ,可以用来浇灌农田。
三、实验题(本题包括2小题,7 5,共12分)
 20、如右图所示,在一烧杯中盛有硫酸溶液,同时有表面光滑的塑料小球悬浮于溶液中央,向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应。试回答: 20、如右图所示,在一烧杯中盛有硫酸溶液,同时有表面光滑的塑料小球悬浮于溶液中央,向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应。试回答:
(1)在此实验过程中,观察到的实验现象有
① _________________________________________
② _____________________________________________________
(2)写出实验过程中反应的离子方程式
____________________ ___________ 。
21、请设计一个只有氯化钡溶液及试管,鉴别碳酸钠溶液和稀硫酸的实验,简要写出鉴别过程和实验结论。
四、计算题(本题包括两小题,4 8,共12分)
22、已知分解100gCaCO3需要177.7kJ的热泪盈眶量,而12g碳完全燃烧,则放出393kJ的热。求:
(1)煅烧1t石灰石需要多少热量?
(2)这些热量全部由碳燃烧提供,问理论上要消耗多少克碳?
23、在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物14 g,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的质量可能各是多少。
参考答案:1、A 2、B 3、C 由所学知识知B和C是吸热反应,但B是非氧化还原反应,C反应是氧化还原反应 4、B 碳酸氢钙是可溶性盐应写成分子的形式,D中注意滴加顺序,酸比较少生成碳酸氢根离子
5、D由电荷守恒知x = 2 ,则原子团M2O7的化合价为- 2价,从而求出M的化合价为 6价,也可由氧化还原反应中得失电子守恒解出答案 6、C 由题给三个反应知,氧化性的强弱为:I2<FeCl3<Cl2<KMnO4若满足题意,加入氧化剂的氧化性应介于I2、Cl2之间,得出答案C 7、D A选项中MnO4-呈紫色;B选项中Ag 和Cl-反应生成AgCl沉淀不能共存;C选项中在酸性溶液中S2-发生反应有硫化氢气体生成 8、D 首先判断发生反应的个数,采用依次连线的方法。 9、C 10、A在反应中氯元素化合价由 5价降到 4价,在氧化还原反应中化合家有升有降,故亚硫酸钠中硫元素的化合价一定升高,高于 4价,为 6价 11、B 12、C 13、C 氧化还原反应有时发生在同种物质的同种元素之间,也可发生在不同的物质的同种元素之间,如:氯气与水反应,二氧化硫与硫化氢反应;化合物之间也能发生氧化还原反应,如二氧化硫和二氧化氮反应生成一氧化氮价和三氧化硫;稀有气体,既不易得电子也不易失电子 14、B 由①得G中氯元素的化合价低于Q中氯元素的化合价,高于-1价(氯的最低化合价为-1价),由②得Q中氯元素的化合价低于X中氯元素的化合价,由③Y中氯元素的化合价介于G、Q中氯元素的化合价之间,由④得Z中氯元素的化合价介于X、Q中氯元素的化合价之间,综合考虑得出答案
15、A 被氧化的硫元素化合价升高到 4价,硫原子为1个;被还原的硫元素化合价降低到-2价,硫原子为2个
16、> ,溶液中发生离子反应,前者H OH- == H2O ,后者Ba2 2OH- 2H SO42- == BaSO4 2H2O ,可见后者和生成更稳定的能量降低,比前者应多放出能量。
17、(1)3Cu+8H 2NO3- =3Cu2 +2NO↑十4H2O ,(2)25% ,3
18、2AgCl Ba(NO3)2 == 2AgCl BaCl2 ;Ag Cl - == AgCl↓
19、(1)K 、Cl - 、OH – (2)铁粉 ,Ag (3)Ag 、Fe3 、Cl - 、OH - ,KNO3
20、(1)有白色沉淀产生;塑料小球下沉。(2)Ba2+ SO42― 2OH― 2H+=2H2O BaSO4↓
21、取两种待鉴溶液于两支试管中,分别滴入BaCl2试剂,都产生白色沉淀,静置,待沉淀沉于试管底后,倒出各自的上层清液,分别滴加到另一支试管中的沉淀中,看沉淀溶解者为BaCO3溶液,则该试管原盛试剂是Na2CO3
22、(1) 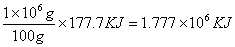
(2) 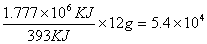
23、(1)
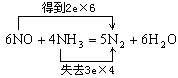
(2)设满足题意时,参加反应的NO、NH3的质量分别为x、y
6NO 4NH3 ==== 5N2 6H2O 经还原得到的N2 - 经氧化得到的N2 = 3N2 – 2N2 = N2
18 68 28
x y 1.4g
解之:x = 9g y= 3.4g
过量质量为:14g – 9g – 3.4g =1.6g
若NO过量,NO的质量为:9g 1.6g = 10.6g ,NH3的质量为:3.4g
若NH3过量,NO的质量为:9g ,NH3的质量为:3.4g 1.6g = 5g
|