| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
25.(8分)(1)铁与氯气反应的方程式为 ,生成物中铁是_______价,铁与盐酸的反应方程式为 ,生成物中铁是________价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)____________。 (2)下列物质能导电的是 ,属于电解质的是 ,属于非电解质是 。 ①干冰 ②烧碱 ③大理石 ④氯化钠溶液 ⑤蔗糖 ⑥铜 26、(13分)已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁。电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。 (1)检验溶液中Fe3 存在的试剂是 ,证明Fe3 存在的现象是 。 (2)写出FeCl3溶液与金属铜发生反应的离子方程式: 。 (3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
A.请写出上述实验中加入或生成的有关物质的化学式: ① ,② ,④ , B.请写出含有②的滤液与⑤反应的化学方程式,并用双线桥法标明电子转移方向和数目。 氧化剂为 还原剂为 。 27.(7分)用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空: (1)配制时所需浓硫酸的体积为 。 (2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒,实验中还需要用到的仪器有 。 (3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响) ①浓硫酸溶解后未冷至室温即进行定容 ; ②定容时俯视刻度线 ; (4)若定容时液面高于刻度线应采取的措施是 。 三、计算题(共2小题,10分) 28.(4分)将11. 2g铁投入200mL某浓度的硫酸中,铁和硫酸恰好完全反应。求: (1)11.2g铁的物质的量 (2)所用硫酸中H2SO4的物质的量浓度 (3)反应中生成的H2在标准状况下的体积 (4)在反应后的溶液中通入1.12 L(标准状况下)Cl2 ,求所得溶液各种离子的物质的量之比。 29.(6分)实验室常用的浓盐酸密度为1.17g.mL-1、质量分数为36.5%。 (1)此浓盐酸的物质的量浓度为 。 (2) 取此浓盐酸50mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 。 (3)将13g锌投入足量的上述实验所得的稀盐酸中,充分反应后,求: ①放出的H2在标准状况下的体积。 ②将生成的H2通过足量的灼热CuO,求被还原出的铜的质量。(假设氢气在反应中没有损失) 三明一中2008~2009学年度上学期学段考试卷高一化学参考答案
一、选择题(共44分,22小题,每题只有一个正确选项,每小题2分)
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
| 11
| C
| D
| C
| A
| B
| A
| A
| C
| B
| D
| C
| 12
| 13
| 14
| 15
| 16
| 17
| 18
| 19
| 20
| 21
| 22
| D
| C
| B
| B
| D
| C
| C
| D
| B
| B
| A |
二、填空题 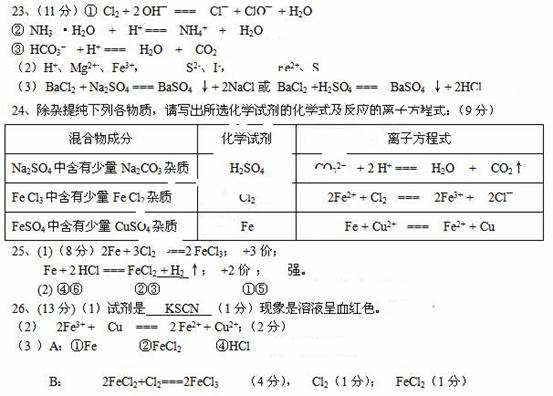
27、(7分)(1) 13.6mL (1分)
(2)20(1分) 烧杯、玻璃棒、胶头滴管、500mL容量瓶(2分)
(3)偏高;偏高 (各1分,共2分) (4)重新配制 (1分)
三、计算题(共10分)
28、(4分)解:(1)0.2mol;(2) 1mol/L ;(3) 4.48L
(4) 2Fe2 Cl2 === 2Fe3 2Cl—
2 22.4 2 2
0.2 1.12 n1 n2
Fe2 过量,用Cl2进行计算,得n1 =0.1 n2=0.1 n3=0.1 nSO42-=0.2
SO42-:Fe2 : Fe3 :Cl- =2:1:1:1
29、(4分)解: (1) 11.7 mol/L(1分) ; (2) 2.925 mol/L(1分)
(3) 解:13gZn的物质的量为:13/65g.mol-1 ==0.2mol
Zn 2HCl ==== ZnCl2 H2
1mol 22.4L V(H2)= 4.48L (1分)
0.2mol V(H2) (4)m(Cu) =12.8g (略)(1分)
| |