|
《卤素》单元检测题
班 姓名 学号 计分
说明: 1、本卷满分100分 时量90分钟
2、本卷可能用到的相对原子质量:H 1 Li 7 C 12 S 32 Na 23 O 16 Cl 35.5 K 39 Rb 85 Cs 133
第Ⅰ卷(选择题 共48分)
一、选择题(每小题只有1个正确答案, 每小题3分,共48分)
1.下列溶液实际上不存在的是 ( )
A .氟水 B. 氯水 C. 溴水 D. 碘水
2.下列物质中,长期露置在空气中,不会变质的是 ( )
A. AgI B. 漂白粉 C. 食盐 D. 次氯酸钙溶液
3.砹是原子序数最大的卤族元素,推测砹的化合物不可能具有的性质是 ( )
A. 砹是有色固体 B. HAt很稳定
C. AgAt难溶于水 D. 砹易溶于某些有机溶剂
4.向溴化钠、碘化钠的混合溶液中通入足量氯气,之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是 ( )
A. NaCl B. NaCl NaBr NaI C. NaBr NaI D. NaI
5.将19gF2通入81g水中,所得溶液中溶质质量分数是 ( )
A. 19% B. 20% C. 21.7% D. 27.5%
6.下列各组物质,不用任何化学试剂即可鉴别的是 ( )
A. 氯化氢、溴化氢、碘化氢 B. 氯水、NaBr溶液、盐酸
C. NaCl溶液、NaBr溶液、KI溶液 D. 盐酸、NaCl溶液、AgNO3溶液、Na2CO3溶液
7.当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是( )
A. AgI比AgCl稳定 B. 碘氧化性比氯弱
C. I-的还原性比Cl-强 D. 溶解度AgI<AgCl
8.大气或饮用水被污染时,可能引起人的牙齿骨骼变酥。引起这一污染的元素是( )
A. 碘 B. 氟 C. 氯 D. 硫
9.氯仿(CHCl3)可用作麻醉剂,但常因保存不慎而被空气氧化,产生光气。
2CHCl3 O2==2HCl 2COCl2(光气)
光气有剧毒。为防止事故发生,用以检验氯仿是否变质的试剂是 ( )
A. 澄清石灰水 B. 硝酸银溶液 C. 漂白粉溶液 D. 氢氧化钠溶液
10.氟是最活泼的非金属,能体现这个结论的是 ( )
A. 氢氟酸是弱酸 B. 氢氟酸是剧毒 C. NaF是农药 D. 氟有XeF2、KrF2等化合物
11. 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,是因为它们均含有( )B
A. 氯气 B. 次氯酸 C. 次氯酸根 D. 氯化氢
12.在盛有KI溶液的试管中,滴入氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是 ( )
A. 上层紫红色,下层接近无色 B. 均匀、透明、紫红色 D
C. 均匀、透明、无色 D. 上层接近无色,下层紫红色
13.有A、B、C三种气体,它们分别是Cl2、HCl、HBr中的一种。已知A、B混合不反应,则以下判断正确的是 ( )
A. C绝不是HCl B. A、B能确定 A
C. C可能是HCl D. C不是Cl2,也不是HBr
14.某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KclO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )D
A. 2:3 B. 4:3 C. 10:3 D. 11:3
15.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以KIO3形式存在,已知在溶液中IO3-和I-发生反应:IO3- 5I- 6H ==3I2 2H2O。根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水、②蓝色石蕊试纸、③KI淀粉试纸、④淀粉、⑤食糖、⑥食醋、⑦白酒。进行上述实验时必须使用的物质是 ( )
A. ①③ B. ③⑥ C. ②④⑥ D. ①②④⑤⑦ B
16. 一种新型的灭火剂“1211”,其化学式是CF2ClBr,命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯数字表示相应元素的原子数目(末尾的“0”可略去)按此原则,对下列几种新型灭火剂的命名不正确的是( )B
A. CF3Br——1301 B. CF2Br2——122 C. C2F4Cl2——242 D. C2ClBr2——2012
二、填空题(共21分)
1、卤化氢皆为 色,卤素为 价的气体,气体溶于水呈 性,其中酸性最弱的是(写化学式) ,酸性最强的是 ,卤化氢的稳定性______>______>_______>_______。
2、在盛有氯气的七个集气瓶中,分别做以下实验:
(1)把燃着的氢气慢慢伸入集气瓶①中,现象是___ _,
化学方程式为_______ _。
(2)用木锉把钠块锉成钠屑并将钠屑撒入集气瓶②中,现象是____ _,
化学方程式为__ __。
(3)把一束细铜丝灼热后,立刻伸入集气瓶③中,现象是_____ ,
化学方程式为____ _,反应后,把少量水注入集气瓶中,压玻璃片后振荡,所得溶液呈___色。
(4)把燃着的红磷放入集气瓶④中,现象是______ 。化学方程式为____ _和____ _。
(5)将湿润的蓝色石蕊试纸伸入集气瓶⑤中,现象是试纸先____ _再___ _,其化学方程式为_____ _ _。
(6)将10mL氢氧化钠溶液注入集气瓶⑥中振荡,所得溶液呈__ _色,其反应的化学方程式为____ _。
(7)将10mL 蒸馏水注入集气瓶⑦中振荡,所得溶液呈__ _色,在日光照射下,溶液的颜色_____ ,其化学方程式为_______ 和
______ __。
3、已知A为氯气,D为硫酸,写出下列变化的化学方程式.
(1) (2)
(3) (4)
三、实验题(20分)
20、某化学课外小组用海带为原料制取了少量的碘水。现有CCl4从碘水中萃取碘并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞上的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)从分液漏斗的上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开,使凹槽对准小孔;
(H)静置,分层。
⑴正确的操作顺序是:(用编号字母填写)_____→_____→_____→(A)→(G)→_____→(E)→(F)。
⑵上述(E)步骤的操作应注意:________________________________________________
___________________________。上述(G)步骤操作的目的是_________________________。
⑶能用CCl4萃取碘的原因是__________________________________________________
__________________________。
⑷下列物质,不能用作从溴水中萃取溴的溶剂是____________。
(A)苯 (B)四氯化碳 (C)酒精 (D)碘化钾
21.工业上从海水中提取溴可采用如下方法:
⑴向海水中通入Cl2,将海水中的溴化物氧化,其离子方程式为____________________。
⑵向上述混合液中吹入热空气,将生成的溴吹出用纯碱溶液吸收,其方程式为________
____________________________。
⑶将⑵所得溶液中用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后还可得到副产品Na2SO4,写出这一过程的化学方程式_________________________________________。
⑷这样得到的溴中还混有少量Cl2,怎样除去?_________________________________
三、计算题(11分)
22、将0.56g氧化钙投入含1.46g氯化氢的盐酸中,当反应完全后,滴入石蕊试剂溶液变成什么颜色?(通过计算回答)
23、A g食盐和B g 98%的浓H2SO4混合后微热,生成无色气体溶于水,然后把剩余物再加热到600℃,又有气体产生.用100mL水吸收后来得到的气体,待反应完全,将所得溶液加入1.7%AgNO3溶液10g,恰好完全反应,问A、B各多少克?
参考答案:
1、A 2、C 3、B 4、A 5、C 6、B 7、D 8、B 9、B 10、D 11、B 12、D
13、A 14、D 15、D 16、B
17、无,-1,酸,HF,HI,HF>HCl>HBr>HI
18、翰林汇(1)氢气继续燃烧,火焰为苍白色,放热,集气瓶口有大量白雾,H2+Cl2 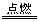 2HCl 2HCl
(2)钠屑在氯气中剧烈燃烧、放热,产生大量白色烟,2Na+Cl2  2NaCl 2NaCl
(3)铜丝在氯气中剧烈燃烧、放热,产生大量棕黄色烟,Cu Cl2  CuCl2,蓝绿 CuCl2,蓝绿
(4)点燃的磷在氯气中继续燃烧、放热,产生大量白色烟雾,
2P+3Cl2  2PCl3,2P+5Cl2 2PCl3,2P+5Cl2  2PCl5 2PCl5
(5)变红色、褪色,Cl2 H2O====HCl HClO
(6)无,Cl2 2NaOH ==== NaCl NaClO H2O
(7)浅黄绿,逐渐消失,Cl2 H2O ==== HCl HClO,2HClO 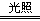 2HCl O2 ↑ 2HCl O2 ↑
19、(1)Cl2 H2O===HCl HClO,2HClO  2HCl O2 ↑ 2HCl O2 ↑
(2)Cl2 2Na  2NaCl (3)H2O SO3===H2SO4 2NaCl (3)H2O SO3===H2SO4
(4)NaCl(固)+H2SO4(浓)  NaHSO4 HCl↑ NaHSO4 HCl↑
20、⑴(C)(B)(D)(A)(G)(H)(E)(F) (2分) ⑵使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不让上层液体流出 使漏斗内外空气相通,以保证进行E操作时漏斗里液体能顺利流出 ⑶CCl4与水互不相溶,而且碘在CCl4中的溶解度比在水中的大得多 ⑷(C)、(D) [第⑵~⑷小题每线2分]]
21、⑴2Br- Cl2==2Cl- Br2 ⑵3Br2 2Na2CO3==5NaBr NaBrO3 3CO2↑
⑶5NaBr NaBrO3 3H2SO4==3Na2SO4 3Br2 3H2O ⑷2FeBr2 3Cl2==2FeCl3 2Br2(每小题2分)
22、根据KI+AgNO3===AgI↓ KNO3,由此可知反应后所得溶液是KNO3溶液。
由质量守恒可知:mKI溶液+mAgNO3溶液===mAgI↓ mKNO3溶液
∵mKI溶液=mKNO3溶液 ∴mAgNO3溶液=mAgI↓
设:生成AgI 235 g,则AgNO3溶液为235 g ,AgNO3为170 g ,硝酸银溶液的质量百分比浓度为: 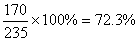
23、解:设10g 1.7%的AgNO3溶液可吸收HCl x g。
AgNO3 HCl===AgCl↓ HNO3
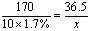 x=0.0365(g) x=0.0365(g)
两次共产生氯化氢2×0.0365=0.073(g)
设0.073 g氯化氢需A g食盐和B g 98%的浓硫酸反应制得。
2NaCl H2SO4  Na2SO4 2HCl Na2SO4 2HCl
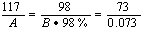 A=0.117(g) B=0.1(g) A=0.117(g) B=0.1(g)
|