| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
二、 常见物质的检验 三、 溶液的配制及分析 1.物质的量的浓度 C(B)= n(B)/V(溶液) 2.物质的量的浓度的配制:计算、称量(或量取)、溶解、转移、洗涤、定容、摇匀、装瓶贴签 具体步骤: (1)计算:固体物质计算所需质量,液体物质计算所需体积; (2)称量(量取):固体用天平,液体用量筒; (3) 溶解(稀释):将固体(溶液)转移至烧杯中,用适量的蒸馏水溶解(稀释),冷却到室温; (4) 转移:将烧杯中的溶液有玻璃棒小心地引流到(适当规格的)容量瓶中: (5) 洗涤:有蒸馏水洗涤烧杯内壁2~3次,并将每次洗涤的溶液都注入到容量瓶; (6)定容:缓缓地将蒸馏水注入到容量瓶中,直到容量瓶中的液面接近容量瓶的刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切; (7)摇匀:将容量瓶盖好,反复上下颠倒,摇匀; (8)装瓶。 第三单元 人类对原子结构的认识 一、 原子结构模型的演变 近代原子结构模型的演变
| 模型
|
| 汤姆生
| 卢瑟福
| 玻尔
| 量子力学
| 年代
| 1803
| 1904
| 1911
| 1913
| 1926
| 依据
| 元素化合时的质量比例关系
| 发现电子
| ɑ粒子散射
| 氢原子光谱
| 近代科学实验
| 主要内容
| 原子是不可再分的实心小球
| 葡萄干面包式
| 含核模型
| 行星轨道式原子模型
| 量子力学 |
1. 核外电子排布规律:
(1) 核外电子总是尽先排布在能量较低的电子层,然后由里向外,排布在能量较高的电子层
(2) 原子核外各电子层最多容纳2n2个电子(表示电子层数)。
(3) 原子最外野电子数目不能超过8个(第一层不能超过2个)
(4) 次外层电子数目不能超过18个(第一层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
SHAPE \* MERGEFORMAT 
 SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT 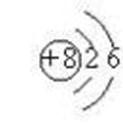

二、原子的构成 SHAPE \* MERGEFORMAT 

|
|

 表示质量数为A、质子数为Z的具体的X原子。
表示质量数为A、质子数为Z的具体的X原子。
|
|
a |
|
b |
|
d |
|
X |
|
e |
|
c |
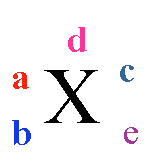

质量数(A)=质子数(Z) 中子数(N)
(1) 原子:核电荷数(质子数)=核外电子数,
(2) 阳离子:核电荷数(质子数)>核外电子数,
(3) 阴离子:核电荷数(质子数)<核外电子数,
核素:具有一定质子数和一定中子数的一种原子。
同位素:质子数相同、质量数(中子数)不同的原子(核素)互为同位素
专题二 从海水中获得的化学物质
第一单元 氯、溴、碘及其化合物
|
2NaCl 2H2O ==== 2NaOH H2↑ Cl2↑
负极 正极
二、氯气的性质
物理性质
1. 颜色:黄绿色2. 气味:刺激性气味3. 状态:气态4. 毒性:有毒5. 密度:比空气大
6. 溶解性:溶于水(1 : 2)
化学性质
![]() 1. Cl2与金属反应(一般将金属氧化成高价态)
1. Cl2与金属反应(一般将金属氧化成高价态)
2. Cl2与非金属反应
![]()
3. Cl2与碱的反应
氯气 碱 → 次氯酸盐 金属氯化物 水
![]()
氯水
![]()
成分 分子:H2O、Cl2、HClO 离子:H 、Cl-(还有ClO-、OH-)
氯水的性质
1. 酸性 2. 氧化性 3. 漂白性 4. 不稳定性
Cl-的检验:试剂:AgNO3溶液和稀硝酸 现象:产生白色沉淀(不溶于稀硝酸)
结论:溶液中有Cl-
次氯酸的性质
1.酸性 2.氧化性 3.漂白性
![]() 4.不稳定性:
4.不稳定性:
氯气的用途: 来水的消毒、农药的生产、药物的合成等
二、 溴、碘的提取
溴和碘的化学性质 元素非金属性(氧化性)强弱顺序:Cl > Br > I
实验
实验现象
化学方程式
氯水与溴化钾溶液的反应
溶液由无色变为橙黄色
2KBr Cl2=2KCl Br2
氯水与碘化钾溶液的反应
溶液由无色变为黄褐(黄)色
2KI Cl2=2KCl I2
溴水与碘化钾溶液的反应
溶液由无色变为黄褐(黄)色
2KI Br2=2KBr I2
单质的物理性质
1.状态:气态(Cl2)→液态(Br2)→ 固态(I2)
2.颜色:黄绿色(Cl2)→深红棕色(Br2)→紫黑色(I2),颜色由浅到深
3.熔、沸点:液态溴易挥发,碘受热易升华
4.溶解性:Cl2溶于水,Br2和I2难溶于水;Br2和I2易溶于汽油、酒精、苯、CCl4等有机溶剂。
I2的检验:试剂:淀粉溶液 现象:溶液变蓝色
Br- 、I- 的检验:
试剂:AgNO3溶液和稀硝酸
现象:产生浅黄色沉淀(含Br-);黄色沉淀(含I-)
例:NaBr AgNO3 = AgBr↓ NaNO3
NaI AgNO3 = AgI↓ NaNO3
第二单元 钠、镁及其化合物
一、 金属钠的性质与应用
钠的性质
物理性质
银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。
化学性质
1、与O2、Cl2、S等非金属的反应
|
|
|
2Na S === Na2S (火星四射,甚至发生爆炸)
2、与水的反应
2Na 2H2O === 2NaOH H2↑ ( 浮、溶、游、红 )
二、 碳酸钠的性质与应用
Na2CO3的性质(水溶液呈碱性)
(1)与碱反应 Na2CO3 Ca(OH)2 === CaCO3↓ 2NaOH
(2)与盐反应 Na2CO3 BaCl2 === BaCO3↓ 2NaCl
(3)与CO2反应: Na2CO3 CO2 H2O ===2NaHCO3
Na2CO3与NaHCO3的性质比较
三、 镁的提取及应用
镁的提取
|
|
|
|
|
CaCO3 === CaO CO2↑
CaO H2O ===Ca(OH)2(石灰乳)
Ca(OH)2 MgCl2 ===Mg (OH)2↓ CaCl2
|
MgCl2 === Mg Cl2↑
物理性质
镁是银白色金属,有金属光泽,密度较小,硬度较大,质地柔软,熔点较低,是热和电的良导体。
化学性质
|
|
|
2Mg CO2 === 2MgO C
2、与水的反应
Mg 2H2O === Mg(OH)2 H2↑
3、与酸的反应
Mg H2SO4 === MgSO4 H2↑
用途
1)镁合金的密度较小,但硬度和强度都较大,因此被用于制造火箭.导弹和飞机的部件
2)镁燃烧发出耀眼的白光,因此常用来制造通信导弹和焰火;
3)氧化镁的熔点很高,是优质的耐高温材料
专题3 从矿物到基础材料
第一单元 从铝土矿到铝合金
一、从铝土矿中提取铝
①溶解:Al2O3 2NaOH === 2NaAlO2 H2O
②过滤:除去杂质
③酸化:NaAlO2 CO2 2H2O === Al(OH)3↓ NaHCO3
|
⑤灼烧:2Al(OH)3 ======= 4Al 3O2↑
铝合金特点:1、密度小2、强度高3、塑性好4、制造工艺简单5、成本低6、抗腐蚀力强
四、 铝的化学性质
(1) 与酸的反应:2Al 6HCl = 2AlCl3 3H2↑
(2) 与碱的反应:2Al 2NaOH 2H2O=2NaAlO2 3H2↑
第一步:2Al 6H2O= 2Al(OH)3 3H2↑
第二步:Al(OH)3 NaOH=NaAlO2 2H2O
★ 总方程式: 2Al 2NaOH 6H2O=2NaAlO2 4H2O 3H2↑
(3) 钝化:在常温下,铝与浓硝酸、浓硫酸时会在表面生成致密的氧化膜而发生钝化,不与浓硝酸、浓硫酸进一步发生反应。
(4)
|
2Al Fe2O3 === 2Fe Al2O3
铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
三、 铝的氢氧化物(两性)
(1) 与酸的反应:Al(OH)3 3HCl = AlCl3 3H2O
(2) 与碱的反应:Al(OH)3 NaOH = NaAlO2 2H2O
Al(OH)3的制备:
H2O
铝盐( AlCl3 ) Al(OH)3↓ 偏铝酸盐( NaAlO2 )
往AlCl3溶液中滴入NaOH溶液:先有白色沉淀产生,后消失;
往NaOH溶液中滴入AlCl3溶液:先无明显现象,后有沉淀产生。
第二单元 铁、铜及其化合物的应用
一、
|
|
|
|
|
(3) 除SiO2:CaCO3===CaO CO2↑,CaO SiO2===CaSiO3
炼铜:1.高温冶炼黄铜矿→电解精制;2.湿法炼铜:Fe CuSO4 = FeSO4 Cu;3.生物炼铜
二、铁、铜及其化合物的应用
铁的化学性质:铁是较活泼的金属(或中等活泼金属)表现为还原性。
|
铁 |
| |||||||||||
|
(1)与非金属反应 |
①铁生锈(铁在潮湿空气中被腐蚀生成Fe2O3)
④3Fe 2O2 === Fe3O4(2价Fe占 |
Cu O2 === 2CuO
| ||||||||||
|
(2)与酸反应 |
①非强氧性的酸:Fe 2H == Fe2 H2↑ ②强氧性的酸(浓H2SO4、HNO3): a.常温下钝化(浓H2SO4、浓HNO3用铁制容器盛装) b.一定条件下反应生成Fe(Ⅲ) |
①非强氧性的酸: 不反应 ②强氧性的酸(浓H2SO4、HNO3):在一定条件下生成Cu(Ⅱ) | ||||||||||
|
(3)与盐溶液反应 |
(1) Fe Cu2 == Fe2 Cu (2) Fe 2Fe3 == 3Fe2 |
Cu 2Ag =2Ag Cu2 Cu 2Fe3 =2Fe2 Cu2 (实验现象:铜粉溶解,溶液颜色发生变化。) |
Fe2 与Fe3 的相互转化:
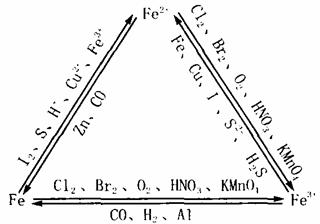
Fe3 的检验:(黄棕色)
实验①:向FeCl3 溶液中加入几滴KSCN溶液,溶液显血红色,
Fe3++3SCN- ![]() Fe(SCN)3
Fe(SCN)3
实验②:向FeCl3溶液加入NaOH溶液,有红褐色沉淀。
Fe3++2OH- ![]() Fe(OH)3↓
Fe(OH)3↓
Fe2 的检验:(浅绿色)
实验:向FeCl2溶液加入NaOH溶液。
Fe2++2OH- ![]() Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O
Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O ![]() 4Fe(OH)3(红褐色)
4Fe(OH)3(红褐色)
三、 钢铁的腐蚀
第三单元 含硅矿物与信息材料
一、硅酸盐矿物、硅酸盐产品(传统材料)和信息材料的介绍
1.硅在自然界的存在:地壳中含量仅次于氧,居第二位。(约占地壳质量的四分之一);无游离态,化合态主要存在形式是硅酸盐和二氧化硅,
2.硅酸盐的结构:
(1)硅酸盐的结构复杂,常用氧化物的形式表示比较方便。硅酸盐结构稳定,在自然界中稳定存在。
(2)氧化物形式书写的规律:
①各元素写成相应的氧化物,元素的价态保持不变。
②顺序按先金属后非金属,金属元素中按金属活动顺序表依次排列,中间用“•”间隔。
③注意改写后应与原来化学式中的原子个数比不变。
3.Na2SiO3的性质:Na2SiO3易溶于水,水溶液俗称“水玻璃”,是建筑行业的黏合剂,也用于木材的防腐和防火。
化学性质主要表现如下:
(1)水溶液呈碱性(用PH试纸测),通CO2有白色沉淀:Na2SiO3 CO2 H2O == Na2CO3 H2SiO3↓(白色胶状沉淀),离子方程式:SiO32- + CO2 H2O == CO32- + H2SiO3↓。
硅酸受热分解:H2SiO3 ![]() H2O SiO2 ,
H2O SiO2 ,
原硅酸和硅酸都是难溶于水的弱酸,酸性:H2CO3强于H4SiO4或H2SiO3。
(2)硅酸钠溶液中滴加稀盐酸有白色沉淀:
Na2SiO3 2HCl == 2NaCl H2SiO3↓,离子方程式:SiO32- + 2H == H2SiO3↓.
(3)硅酸和氢氧化钠反应:H2SiO3 2NaOH == Na2SiO3 2H2O.
离子方程式:H2SiO3 + 2OH- ==SiO32- +2H2O 。
4.硅酸盐产品(传统材料)
主要原料
产品主要成分
普通玻璃
石英、纯碱、石灰石
Na2SiO3、CaSiO3、SiO2(物质的量比为1:1:4)
普通水泥
黏土、石灰石、少量石膏
2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3
陶瓷
黏土、石英沙
成分复杂主要是硅酸盐
制玻璃的主要反应:SiO2 Na2CO3 ![]() Na2SiO3 CO2↑,SiO2 CaCO3
Na2SiO3 CO2↑,SiO2 CaCO3 ![]() CaSiO3 CO2↑.
CaSiO3 CO2↑.
二、硅单质
1.性质:(1)物理性质:晶体硅是灰黑色有金属光泽,硬而脆的固体;导电性介于导体和绝缘体之间,是良好的半导体材料,熔沸点高,硬度大,难溶于溶剂。
(2)化学性质:常温只与单质氟、氢氟酸和强碱溶液反应。性质稳定。
Si 2F2 == SiF4(气态), Si 4HF == SiF4 2 H2,
![]() Si 2NaOH H2O == Na2SiO3 2H2↑,(Si 2NaOH 4H2O == Na2SiO3 2H2↑ 3H2O.)
Si 2NaOH H2O == Na2SiO3 2H2↑,(Si 2NaOH 4H2O == Na2SiO3 2H2↑ 3H2O.)
|
3.硅的用途:(1)用于制造硅芯片、集成电路、晶体管、硅整流器等半导体器件;(2)制造太阳能;(3)制造合金,如含硅4%(质量分数)的钢导磁性好制造变压器的铁芯;含硅15%(质量分数)的钢有良好的耐酸性等。
4.工业生产硅:
制粗硅:SiO2 2C ![]() Si 2CO
Si 2CO
制纯硅:Si 2Cl2 ![]() SiCl4(液态)
SiCl4(液态)
SiCl4 2H2 ![]() Si 4HCl
Si 4HCl
三、二氧化硅的结构和性质:
1.SiO2在自然界中有较纯的水晶、含有少量杂质的石英和普遍存在的沙。自然界的二氧化硅又称硅石。
2.SiO2物理性质:硬度大,熔点高,难溶于溶剂(水)的固体。
3.SiO2化学性质:常温下,性质稳定,只与单质氟、氢氟酸和强碱溶液反应。
SiO2 2F2 == SiF4 O2 , SiO2 4HF == SiF4 2H2O (雕刻玻璃的反应),
SiO2 2NaOH == Na2SiO3 H2O (实验室装碱试剂瓶不能用玻璃塞的原因).
加热高温:SiO2 2C ![]() Si 2 CO, SiO2 Na2CO3
Si 2 CO, SiO2 Na2CO3 ![]() Na2SiO3 CO2↑
Na2SiO3 CO2↑
SiO2 CaCO3 ![]() CaSiO3 CO2↑,SiO2 CaO
CaSiO3 CO2↑,SiO2 CaO ![]() CaSiO3 .
CaSiO3 .
4.SiO2的用途:制石英玻璃,是光导纤维的主要原料;制钟表部件;可制耐磨材料;用于玻璃的生产;在光学仪器、电子工业等方面广泛应用。
专题四 硫、氮和可持续发展
第一单元 含硫化合物的性质和应用
一、硫酸型酸雨的成因和防治 :
1.含硫燃料(化石燃料)的大量燃烧
涉及到的反应有:
![]() 2SO2 O2 2SO3 SO3 H2O = H2SO4
2SO2 O2 2SO3 SO3 H2O = H2SO4
SO2 H2O ![]() H2SO3 2H2SO3 O2 = 2H2SO4
H2SO3 2H2SO3 O2 = 2H2SO4
2.防治措施:
①从根本上防治酸雨—开发、使用能代替化石燃料的绿色能源(氢能、核能、太阳能)
②对含硫燃料进行脱硫处理(如煤的液化和煤的气化)
③提高环保意识,加强国际合作
二、SO2的性质及其应用
1.物理性质:无色、有刺激性气味、有毒的气体,易溶于水
* 大气污染物通常包括:SO2、CO、氮的氧化物、烃、固体颗粒物(飘尘)等
2.SO2的化学性质及其应用
⑴SO2是酸性氧化物
SO2 H2O ![]() H2SO3
H2SO3
SO2 Ca(OH)2 = CaSO3↓ H2O;CaSO3 SO2 H2O = Ca(HSO3)2
SO2 2NaOH = Na2SO3 H2O(实验室用NaOH溶液来吸收SO2尾气)
* 减少燃煤过程中SO2的排放(钙基固硫法)
![]() CaCO3 CaO CO2↑;CaO SO2 = CaSO3
CaCO3 CaO CO2↑;CaO SO2 = CaSO3
SO2 Ca(OH)2 = CaSO3 H2O
2CaSO3 O2 = 2CaSO4
⑵SO2具有漂白性:常用于实验室对SO2气体的检验
漂白原理类型
①吸附型:活性炭漂白——活性炭吸附色素(包括胶体)
②强氧化型:HClO、O3、H2、Na2O2等强氧化剂漂白——将有色物质氧化,不可逆
③化合型:SO2漂白——与有色物质化合,可逆
⑶SO2具有还原性
![]() 2SO2 O2 2SO3
2SO2 O2 2SO3
SO2 X2 2H2O = 2HX H2SO4
三、接触法制硫酸
流程 设备 反应
![]()
![]() 生成二氧化硫 沸腾炉 S O2 SO2 或4FeS2 11O2 2Fe2O3 8SO2
生成二氧化硫 沸腾炉 S O2 SO2 或4FeS2 11O2 2Fe2O3 8SO2
![]() SO2接触氧化 接触室 2SO2 O2 2SO3
SO2接触氧化 接触室 2SO2 O2 2SO3
SO3的吸收 吸收塔 SO3 H2O = H2SO4
* 为了防止形成酸雾,提高SO3的吸收率,常用浓硫酸来吸收SO3得到发烟硫酸
四、硫酸的性质及其应用
1.硫酸的酸性:硫酸是二元强酸 H2SO4 = 2H SO42- (具有酸的5点通性)
如:Fe2O3 3H2SO4 = Fe2(SO4)3 3H2O 硫酸用于酸洗除锈
2.浓硫酸的吸水性:浓硫酸具有吸水性,通常可用作干燥剂
3.浓硫酸的脱水性:浓硫酸将H、O按照2∶1的比例从物质中夺取出来,浓硫酸用作许多有机反应的脱水剂和催化剂。
4.浓硫酸的强氧化性:
![]() Cu 2H2SO4(浓) CuS O4 SO2↑ 2H2O
Cu 2H2SO4(浓) CuS O4 SO2↑ 2H2O
浓硫酸可以将许多金属氧化:金属 浓硫酸 → 硫酸盐 SO2↑ H2O
浓硫酸的氧化性比稀硫酸强:浓硫酸的强氧化性由 6价的S引起,而稀硫酸的氧化性由H 引起(只能氧化金属活动顺序表中H前面的金属)。
![]() C 2H2SO4(浓) CO2↑ 2SO2↑ 2H2O
C 2H2SO4(浓) CO2↑ 2SO2↑ 2H2O
二、硫及其化合物的相互转化
1.不同价态的硫的化合物
-2价:H2S、Na2S、FeS; 4价:SO2、H2SO3、Na2SO3
6价:SO3、H2SO4、Na2SO4、BaSO4、CaSO4 、FeSO4
2.通过氧化还原反应实现含不同价态硫元素的物质之间的转化
![]()
![]()
![]() -2 0 4 6
-2 0 4 6
S S S S
![]() SO42-离子的检验:SO42- Ba2 = BaSO4↓
SO42-离子的检验:SO42- Ba2 = BaSO4↓
![]() 取少量待测液 无明显现象 产生白色沉淀
取少量待测液 无明显现象 产生白色沉淀
第二单元,生产生活中的含氮化合物
一、氮氧化物的产生及转化
|
N2 O2===2NO
2NO O2===2NO2
3NO2 H2O===2HNO3 NO
|
|
(1)、环境问题是如何出现的?(1)、人类不当使用科学技术的结果
(2)、产生环境问题的根源是什么?(2)、极力追求商业利润
(3)、克服环境问题有哪些途径?(3)、治理,使用新技术,改变生活方式,环境意识教育
二、氮肥的生产和使用
|
|
2.实验室制取氨气
2NH4Cl Ca(OH)2====CaCl2 2NH3↑ 2H2O
3.氨气的性质
![]() :氨气易溶于水,溶于水显碱性,能使湿润的红色石蕊试纸变蓝。氨水易挥发,不易运输,但成本低。氨水应在阴凉处保存。雨天、烈日下不宜施用氨态氮肥。
:氨气易溶于水,溶于水显碱性,能使湿润的红色石蕊试纸变蓝。氨水易挥发,不易运输,但成本低。氨水应在阴凉处保存。雨天、烈日下不宜施用氨态氮肥。
与酸的反应 NH3 HCl===NH4Cl(产生白烟) 2NH3 H2SO4===(NH4)2SO4
|
喷泉实验:(1).实验装置的工作原理?(2).溶液变红色的原因?(3).喷泉的发生应具备什么条件?
三、硝酸的性质
1.物理性质:无色,具有挥发性的液体
2.化学性质:
(1)不稳定性 ![]() 见光或加热会分解释放出
见光或加热会分解释放出 ![]() 气体
气体
4HNO3==4NO2↑ O2↑ 2H2O
(2)强氧化性
![]() 是一种强氧化性的酸,绝大多数金属及许多非金属单质能与硝酸反应.。
是一种强氧化性的酸,绝大多数金属及许多非金属单质能与硝酸反应.。
|
C 4HNO3==CO2↑ 4NO2↑ 2H2O 一般生成 ![]() 气体。
气体。
稀 ![]() :
: ![]() 一般生成
一般生成 ![]() 气体。
气体。
另外,
(1) ![]()
![]()
适用:固+液 ![]() 气体。方法最为简便。后者反应更剧烈,应对浓硝酸的滴加予以控制。
气体。方法最为简便。后者反应更剧烈,应对浓硝酸的滴加予以控制。
| |||
| |||
(2)C 4HNO3==CO2↑ 4NO2↑ 2H2O 4HNO3==4NO2↑ O2↑ 2H2O
|
![]() 适用:固+液 气体。方法较为繁锁,且产物中有杂质气体。
适用:固+液 气体。方法较为繁锁,且产物中有杂质气体。
| |