|
专题一 微观结构与物质的多样性 单元检测题
命题教师:叶文洋 胡志新(三门中学)
一选择(每题只有一个正确选项,每题2分)
1.十九世纪中叶,门捷列夫的突出贡献是( )
A 提出原子学说 B 发现元素周期律
C 提出分子学说 D 发现分子间力
2.Na和Na 两种粒子中,不相同的是( )
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数
A ①、② B ②、③ C ③、④ D ②、③、④
3.下列说法中,不符合ⅦA元素性质特征的是( )
A从上到下原子半径逐渐减小 B易形成-1价离子
C最高价氧化物的水化物显酸性 D从上到下氢化物的稳定性依次减弱
4.下列说法中,正确的是( )
A在周期表里,主族元素所在的族序数等于原子核外电子数
B在周期表里,元素所在的周期数等于原子核外电子层数
C最外层电子数为8的粒子是稀有气体元素的原子
D元素的原子序数越大,其原子半径也越大
5.下列各组物质中,化学键类型相同的是()
A HCl和KCl B H2S和Na2S
C CH4和H2O D H2SO4和Na2SO4
6.下列说法正确的是( )
A 同素异形体间的化学式一定相同 B同素异形体间的结构一定相同
C 同分异构体间的化学式一定相同 D同分异构体间的结构一定相同
7.共价键,离子键,和分子间作用力是物质间的不同作用力,下述物质中只含上述一中作用力的是()
A 干冰 B 氯化钠 C 氢氧化钠 D 碘
8.有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b,阴离子所带负电荷数c>d,则四种元素的原子序数关系是( )
A a>b>c>d B b>a>d>c C c>b>a>d D b>a>c>d
9.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A H2XO3 B HXO3 C H3XO4 D H2XO4
10.在短周期元素中,原子最外电子层只有1个或2个电子的元素( )
A是非金属元素 B是稀有气体元素
C是金属元素 D无法确认为哪一类元素
二.选择(每题只有一个正确选项,每题3分)
11.乙酸( 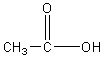 )和甲酸甲脂( )和甲酸甲脂( 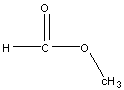 )的关系是( ) )的关系是( )
A同分异构体 B同素异形体
C同位素 D同一种分子
12.镭是周期表中第7周期第ⅡA主族元素,下列关于镭的性质描述中不正确的是( )
A 在化合物中呈 2价 B 镭比钙的金属性强
C 氢氧化物呈两性 D 碳酸盐难溶于水
13.关于Na元素和F元素的叙述正确的是()
A原子序数Na>F
B原子半径Na<F
C原子的电子层数Na<F
D原子最外层电子数Na>F
14.已知X,Y为短周期元素,两元素形成化合物XY2,已知起原子序数分别为a和b,则a不可能为( )
Ab 4 Bb-5 Cb 6 Db 8
15.短周期元素X,Y,Z在周期表中的位置如右图所示,则下列说法中错误的是()
AX,Y,Z中X的单质最稳定
BY的氢化物为HY
CX能生成HXO
D能发生Cl2 H2Z====Z 2HCl的反应
16.下列各组元素,两两结合形成的化合物既有以离子键相结合的又有以共价键相结合的是( )
A H O K B Mg K Cl C C H O D Mg N Ne
17.砹(At)是原子序数最大的卤族元素,推测砹及砹的化合物最不可能具有的性质有( )
A.砹是有色固体 B.砹易溶于有机溶剂 C.HAt 很稳定 D.AgAt不溶于水
18.下列性质可以证明化合物内一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
19.下列各组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是( )
A.食盐和蔗糖溶于水 B.氯化钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
20.下列说法正确的是()
A含有离子键的化合物必是离子化合物。
B含有共价键的化合物必是共价化合物。
C共价化合物中可能含有离子键。
D离子化合物中一定不含共价键。
21.当SO3晶体融化或升华时,下述发生变化的是()
A分子内的化学键 B分子内的原子个数
C分子的空间构型 D分子间的距离
22.据报道,科学家在宇宙中发现H3分子,H3和H2属于()
A 同位素 B 同素异形体 C 同分异构体 D同种物质
23.下列变化中,吸收的热量用于克服分子间作用力的是()
A 加热金属铝使之融化
B 液氨受热蒸发
C 加热碘化氢气体使之分解
D 加热硅晶体使之融化
24.红磷和白磷在一定条件下相互转化,这一变化( )
A是物理变化 B是化学变化 C 是氧化还原反应 D是分解反应
25.近年来,科学家发现一种新分子,它具有空心的类似足球状的结构,化学式为C60。下列说法中,正确的是( )
A C60是一种新型化合物
B C60分子内含有离子键
C C60在纯氧中充分燃烧后只生成唯一产物CO2
D C60的摩尔质量为720
三. 填空题
26.(3分)质量数为23,中子数为12的原子的原子结构示意图:
27.(每空2分)下列物质属于离子晶体 ,属于分子晶体的是 ,原子晶体 ,金属晶体 。
①铁 ②干冰 ③金刚石 ④铜 ⑤水晶 ⑥氯化钠 ⑦碘 ⑧氢氧化钠
28.(每个2分)书写下列物质的电子式
NaCl NH4Cl NaOH
29.(每空1分)将下列物质进行分类(填序号)
①126C与136C ②O2与O3 ③金刚石与石墨 ④冰与水
⑤  和 和 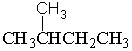
(1) 互为同位素的是
(2) 互为同素异形体的是
(3) 互为同分异构体的是
(4) 属于同一化合物的是
30.X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z的元素符号分别是: (3分)
(2)有X、Y、Z所形成的离子化合物是 它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是
(4分)
四.计算(7分)
31 。3.2 g某元素A的单质与氢气化合生成3.4 g气态氢化物H2A,已知A的原子核中质子数和中子数相等,则:
(1)A的原子序数为?(2分)
(2)元素A位于元素周期表中什么位置?(2分)
(3)气态氢化物的化学式是什么?(1分)并书写气态氢化物的电子式。(2分)
答案:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
B |
D |
A |
B |
C |
C |
B |
B |
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
D |
D |
A |
C |
A |
A |
C |
A |
|
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
C |
D |
C |
A |
D |
B |
B |
B |
|
25 |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
26 略
27 6 8,2 7 ,3 5,1 4
28 略
29 1, 2 3,5 ,4
30 (1)H N O
(2)NH4NO3 NH4NO3 NaOH ==== NH3 ↑ Na NO3 H2O
31 (1) 16
(2) 第三周期、第ⅥA主族
(3) H2S 略
|