|
原子量:H-1 O-16 S-32 N-14 C-12 Cl-35.5 Na-23 Mg-24 Al-27 Fe-56
一.选择题(单选)
1.常况下,以固态存在的卤素单质是:
A. F2. B.Cl2. C.Br2. D.I2.
2.随着核电荷数的递增,下列卤素性质递变描述正确的是:
A. 熔点和沸点降低. B.卤化气的稳定性增强.
B. 结合电子能力增强. D.非金属性增强.
3.下列气体在水中溶解度最大的是:
A. 氯化氢. B.氢气. C.氧气. D.氯气.
4.使碘从它的溶液中分离出来的有效方法是:
A.蒸馏. B.结晶. C.升华. D.过滤.
5. 下列关于氯气的说法不正确的是:
(A) 常温下是黄绿色气体较易溶于水.
(B) 双原子分子,在反应中常做氧化剂.
(C) 加热时与适量铁粉反应,生成氯化亚铁.
(D) 实验室里可用排饱和食盐水收集氯气.
6. 为防止贮存液氯的钢筒被腐蚀,钢筒装液氯之前必须:
(A) 充入惰气 (B) 除去铁锈 (C) 彻底干燥 (D) 放入铁粉
7. 下列物质加入硝酸银溶液后,不能生成黄色沉淀的是:
(A) 碘水 (B) 碘酸钾 (C)碘蒸气 (D)碘化钾
8. 三种黑色粉末:二氧化锰,炭粉,氧化铜,可将它们鉴别的一种物质是
(A) 浓盐酸 (B) 烧碱溶液 (C) 红墨水 (D) 稀盐酸
9.下列各组反应时只生成白烟的是
(A) 氢气在氯气中燃烧 (B) 钠在氯气燃烧
(C) 红磷在氯气中燃烧 (D) 铜丝在氯气中燃烧
10. 在下列反应中,水做还原剂的是
(A) 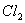 +H2O (B) F2+H2O (C)SO2+H2O (D) +H2O (B) F2+H2O (C)SO2+H2O (D) 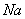 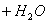
11.下列变化中,属于化学变化的是
(A) 碘升华 (B) 液溴挥发
(C) 用四氯化碳从溴水中萃取溴. (D) 氢氟酸雕刻玻璃.
12. 在 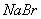 与 与 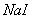 的混合溶液中,通入过量的氯气,把溶液蒸干后,再将剩 的混合溶液中,通入过量的氯气,把溶液蒸干后,再将剩
余 物灼烧,最后残留物是:
(A) 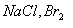 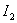 (B) (B) 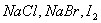
(C) 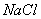 (D) (D) 
13.下列物质中,不能使湿润的淀粉碘化钾试纸变蓝色的是:
(A) 碘水 (B) 盐酸 (C) 溴蒸气 (D) 氯水
14.将下列各种液体分别用溴水混和并振荡,静止后混和液分为两层,溴水层几乎呈无色的是:
(A) 氯水 (B) 四氯化碳 (C) 碘化钾溶液 (D) 食盐水
15.用 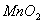 与浓盐酸反应制取 与浓盐酸反应制取 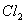 ,当有4摩尔 ,当有4摩尔 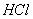 被氧化时,生成的氯气在标准状态下的体积为: 被氧化时,生成的氯气在标准状态下的体积为:
(A) 22.4升 (B) 11.2升 (C) 44.8升 (D)89.6升
16.甲,乙,丙三种溶液各含有一种X-(X-为 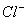 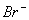 或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化.则甲,乙,丙依次含有: 或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化.则甲,乙,丙依次含有:
(A)I-, 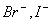 (B) (B) 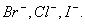 (C) (C) 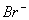 I- I- 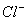 (D) (D) 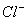 I- I- 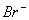
17.下列说法正确的是:
A. 1gH2所占的体积是11.2升.
B. 200C时,1molO2的体积比22.4升大.
C. 物质的量相同的氢气和氮气,在同温同压下,其体积一定相等.
D. 某物质如果含有阿伏加德罗常数个微粒,该物质在标准状态下的体积为22.4升.
18.下列物质在标准状态下,所占体积最小的是:
A. 20g水. B. 16g O2. C. 1024个SO2分子. D. 112mLN2
19.下列各组物质中,分子数相同的是:
A. 4克H2与28克N2. B. 22 克CO2与11.2升CO
C.. 2mol氯化氢气体与44.8升N2. D. 9克水(40C)和0.5molCO2.
20.同温、同压、同质量的下列气体,体积最大的是:
A. 甲烷. B. 氯气. C. 二氧化碳. D. 氧气.
21.下列说法不正确的是:
A. 3mol氧原子. B. 2molNH3的质量是34克.
C.. NaOH的摩尔质量为40克. D.2mol氦.
22. 某物质的分子数为15.05 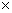 1022个时,其质量是8.5克,该物质的式量是: 1022个时,其质量是8.5克,该物质的式量是:
A. 34. B. 44. C. 17. D. 36.5
23.下列物质中,含原子个数最多的是:
A. 71克Cl2. B. 0.5molKClO3. C. 2mol氩气. D. 0.4molH2SO4.
24.各取0.1mol钠、镁、铝、铁分别跟足量的盐酸反应,生成的氢气在标准状态下,体积最大的是:
A.钠. B. 镁 . C. 铝. D. 铁.
25.用20克NaOH配制250mL溶液,从中取出5mL溶液加水稀释至100mL,稀释后溶液的物质的量浓度是
A. 2mol/L. B. 0.1mol/L. C. 1mol/L. D. 0.2mol/L.
26. 在30 mL1mol/L的KOH溶液中,加入10mL2mol/L的稀盐酸,最后加入少量紫色石蕊试液,则溶液的颜色是:
A. 紫色. B. 蓝色. C. 无色. D. 红色.
27.煅烧石灰石制生石灰是个吸热反应,每1mol石灰石分解时需要吸收159kJ的热量,下列石灰石分解的热化学方程式正确的是:
A. CaCO3=CaO+CO2-159kJ
B. CaCO3=CaO+CO2(气)-159kJ.
C. CaCO3(固)=CaO(固)+CO2(气)+159kJ.
D. CaCO3(固)=CaO(固)+CO2(气)-159kJ.
28.2mol/L盐酸和4mol/L盐酸各1L混合,混合溶液的物质的量浓度是:
A.6mol/L. B. 3mol/L. C. 1.5mol/L. D. 1mol/L.
29.要使30mL0.4mol/L的碳酸钠中的CO32-全部沉淀,需要用1.2mol/L 某金属Zn+的溶液10mL,则n值是:
A.1.2. B. 1. C. 2. D. 3.
30.在V毫升水中加入W克C%的氯化钠溶液,搅拌后测得该溶液密度是d克/厘米3,所得溶液的物质的量浓度的正确表示式是:
A. 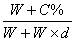 B. B. 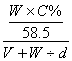 C. C. 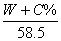 D. D. 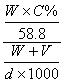
31.下列各种物质中,原子数相等的一组是:
①44克CO2. ②71克Cl2. ③44克SO2.
④1molH2S. ⑤1.5molH2. ⑥3.02 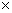 1023个溴分子。 1023个溴分子。
A.①③. B.③⑤. C.②⑥. D.①④⑤
32.1mol/L盐酸与2mol/LNaOH溶液混合后,溶液中的OH-的物质的量浓度是:
A.2mol/L B.1mol/L C.0.5mol/L D.0.25mol/L
33.300mL某浓度的NaOH溶液中,含有溶质60克,现欲配制1mol/LNaOH溶液,应取原溶液与蒸馏水的体积比约为:
A.1:4 . B. 1:5. C. 2:1. D. 2:3
34. 2molC l2与4克H2反应后,
A.氢气和氯气恰好完全反应. B.氯气有剩余.
C. 氢气有剩余. D.无法判断哪种物质过量.
35.用准确称量的氯化钠固体配制0.1mol/L的氯化钠溶液750 mL.要用到的仪器是:①烧瓶.②烧杯.③500mL容量瓶.④250mL容量瓶.⑤1000mL容量瓶.
⑥胶头滴管.⑦移液管.⑧玻棒.
A.①②③④⑥. B.②③④⑤. C.②⑤⑥⑧. D.②③④⑤⑧.
选择题答案:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
D |
D |
A |
C |
C |
C |
B |
A |
B |
B |
D |
C |
B |
B |
C |
C |
C |
A |
|
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
|
|
D |
A |
C |
A |
D |
C |
B |
B |
D |
B |
A |
D |
D |
B |
A |
A |
C |
|
高一化学中段考试题
班级 _______ 姓名_______ 学号________
请把选择题答案填入下表:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二.填空题:
36.(6分)卤素元素主要包括____________________等五种元素,它们原子结构的共同点是_______________________,但__________和___________不同,所以,性质上存在递变关系,其中,最稳定的氢化物是_______,氧化性最强的单质是_____.
37.(8分)实验室用下列装置制备氯气,并进行氯气性质实验,请回答下列问题:
(1).A、B各是什么物质________、________。
(2).C装置是为了除去氯气中的氯化氢气体,C装置应放入__________.
(3).D装置是为了干燥氯气的,D装置应放入_____________.
(4).E中有一干燥的红色布条,观察到的现象是________________.
(5).F中装有碘化钾溶液和四氯化碳混合液,观察到的现象是___________.
有关的化学反应方程式是_____________________________________.
(6).G中装有氢氧化钠溶液,其作用是______________,
化学反应方程式____________________________________.
38.(3分)可用作感光材料的是____________;可作人工降雨剂的物质是__________;可用来雕刻玻璃的物质是_________________.
39.(6分)在化学方程式上标出电子转移方向和数目,并回答问题:
①.FeO+CO 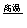 Fe+CO2 氧化剂是_______,被氧化元素是____________. Fe+CO2 氧化剂是_______,被氧化元素是____________.
②.2H2S+SO2=3S+2H2O 还原剂是_______,生成0.3molS单质时,被还原的
S元素为________克.
三.计算题.(7分)
40.将0.3molH2在7.1gCl2的容器内充分燃烧,生成的HCl溶于水中制成100mL稀盐酸,这种盐酸的物质的量浓度是多少?在这种盐酸中加入75mL某NaOH溶液时,恰好中和,求这种NaOH溶液的物质的量浓度是多少?
|