| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
下列对该样品的推断正确的是 A、样品为纯净物 B、样品中混有不溶于水的杂质 C、样品中混有溶解度较大的杂质 D、当温度在550C左右时KNO3完全溶解 第II卷(非选择题,共72分) 15、(12分)某化学研究性学习小组探讨Fe3 和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。 (1)提出猜想: 甲同学认为发生双水解反应:Fe3 SO32- 6H2O=2Fe(OH)3(胶体) 3H2SO3 乙同学认为发生氧化还原反应,其反应方程式为 (2)实验验证:丙同学设计了下列实验来探究反应的可能性。 ①为了检验所用的Na2SO3是否变质,应选用的试剂是 ②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成) ③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变为血红色 (3)得出结论: ①根据丙同学的实验得出的结论是: ②实验③中溶液变成血红色的离子方程式为 (4)拓展探究: 丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体。从形式上看,Na2CO3 和Na2SO3相似,但二者的水溶液与氯化铁溶液反应的现象差别很大,其原因是 (1)Fe3 SO32- 6H2O= Fe2 SO42 2H (2)BaCl2 和稀盐酸 (3)两个反应同时发生, Fe(OH)3(胶体) SCN-= Fe(SCN)3 3OH- (4) SO32- 水解能力较CO32-小,且SO32-具有还原性
已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题: (1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为_____________________________________________________(2)写出电解E水溶液的化学方程式_____________________。 (3)J与H反应的离子方程式为__________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C K→A L的变化时,为了最终得到J,则A、B的物质的量之比为______。 (1)2Al Fe2O3=2Fe Al2O3 (2)2Cl- 2H2O=2OH- H2 Cl2 (3)4OH- Al3 =AlO2- 2H2O 3:4 17、(14分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题: (1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H 浓度之比是 。 (2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。 (3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
当反应达到平衡时不断改变条件(不改变A2、C2 和CA3的量),右图表示反应速率与反应过程的关 系,其中表示平衡混合物中CA3的含量最高的一 段时间是 。温度为T℃时,将4a molA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数
其中,g是常用调味品的主要成分。写出反应①的化学方程式
设计实验方案完成d→e的转化
(1)1:10000 (2)Ba2 OH- HCO3-=BaCO3 H2O (3)Al-3e=Al3 (4)t0---t1 2.25/8 (5)CH3COOCH2CH3 NaOH=CH3COONa CH3CH2OH 用铜作催化剂通人氧气加热 18、(14分)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
请完成下列各题: (1)写出反应类型:反应① 反应④ (2)写出反应条件:反应③ 反应⑥ (3)反应②③的目的是: 。 (4)写出反应⑤的化学方程式: 。 (5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。 (6)写出G的结构简式 。 (1)加成反应 取代反应 19、(11分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ①
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ②
|
|
|
|
|
|
|
|
|
|
|
| ③
|
|
|
|
|
| ④
|
|
|
|
|
|
|
|
|
|
| ⑤
|
|
| ⑥
| ⑦
|
|
| ⑧
|
|
|
|
|
| ⑨
|
|
| ⑩
|
|
|
|
|
|
| |
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的常见化合物的晶体类型是________________。
(3)某元素的特征电子排布式为nsnnpn 1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素 = 2 \* GB3 ②的氢氧化物有相似的性质。请写出元素 = 2 \* GB3 ②的氢氧化物与NaOH溶液反应的化学方程式: 。
(5) 1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。

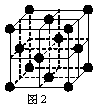
在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________, 转变温度前后两者的密度比(1183 K以下与1183 K以上之比)___________。(用根号表示)
(1)⑨ (1分) (2)苯 (1分) 分子晶体 (1分)(3) 1 (1分)三角锥形 (1分)(4) Be(OH)2 2NaOH=Na2BeO2 2H2O (1分)(5)8 (1分)12 (1分) ![]() (2分)
(2分)
20、(9分)已知下列几种烷烃的燃烧热如下:
烷 烃
甲烷
乙烷
丙烷
丁烷
戊烷
燃烧热/(kJ·mol-1)
890.3
1559.8
2219.9
2877.0
3536.2
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
⑴试写出乙烷气体燃烧的热化学方程式 ;
⑵计算该天然气中甲烷的体积分数
⑶由上表可总结出的近似规律是____________________
_。
⑴2C2H6(g) 7O2(g) ![]() 4CO2(g) 6H2 (g) △H = —3119.6kJ/mol;(2分)
4CO2(g) 6H2 (g) △H = —3119.6kJ/mol;(2分)
⑵72% (4分)
⑶烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右(3分)
| |