| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
A.15.7 g混合物恰好与盐酸完全反应 B.加入混合物9.2 g时盐酸不足量 C.盐酸的物质的量浓度为3.0 mol·L-1 D.根据表中数据不能计算出混合物中NaHCO3的质量分数 15.银锌电池广泛用于各种电子仪器,电池反应为:Ag2O Zn H2O A.电池在放电时,Ag电极是电池的负极 B.充电时阳极发生的电极反应是:2Ag 2OH--2e-=Ag2O H2O C.该电池可用酸作电解质溶液 D.放电时电流从Zn电极经外电路流向正极 16.下表为有关化合物的pksp,pksp=-lgksp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY ,则沉淀转化为AgY;③向②中加入Na2Z,沉淀又转化为Ag2Z。则表中a、b、c的大小关系为 ( )
| 相关化合物
| AgX
| AgY
| Ag2Z
| pksp
| a
| b
| c |
A.a>b>c B.a<b<c C.c<a<b D.a b=c
第Ⅱ卷 (非选择题 共52分)
二、必做题(本题包括4小题,共44分)
 17.(12分) 2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。表面化学领域的研究可以帮助我们了解众多纷杂的化学过程,如钢铁为何会生锈,燃料电池如何作用以及某些反应的催化剂是如何发挥其功能的,甚至可以解释臭氧层的消耗现象等。
17.(12分) 2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。表面化学领域的研究可以帮助我们了解众多纷杂的化学过程,如钢铁为何会生锈,燃料电池如何作用以及某些反应的催化剂是如何发挥其功能的,甚至可以解释臭氧层的消耗现象等。
⑴某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
⑵在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
⑶①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
|
该反应的平衡常数K的表达式为:K=_______。升高温度,K值 (填“增大”、“减小”或“不变”)。
= 3 \* GB3 ③合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2 与Fe3 的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C ![]() 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为 g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为 g。
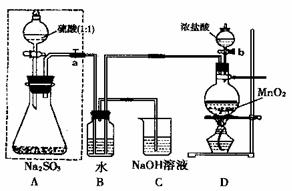 18.(14分)长期存放的Na2SO3会被空气中的氧气部分氧化。某化学爱好小组通过实验测定某无水Na2SO3被氧化的程度。请回答:
18.(14分)长期存放的Na2SO3会被空气中的氧气部分氧化。某化学爱好小组通过实验测定某无水Na2SO3被氧化的程度。请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,应如何检查虚线框内装置的气密性?
(2)写出B装置中反应的离子方程式 。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
|
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量硝酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将滤液蒸干,称量得固体m3g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
19.(10分) 已知物质M由X、Y两短周期且同周期元素组成,X原子的最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价的代数和为6,M与其它物质的转化关系如下(部分产物已略去)

(1)若A是与X、Y同周期元素的一种单质,当F的水溶液过量时,G为可溶性盐,当F的水溶液不足时,G为沉淀,则E与过量F溶液反应的离子方程式为____________
(2) 若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式为______
 (3) 若A是一种常见化肥,式量为78,且E与F反应生成G时有白烟产生,则溶液中A与足量B加热时反应的离子方程式为__________
(3) 若A是一种常见化肥,式量为78,且E与F反应生成G时有白烟产生,则溶液中A与足量B加热时反应的离子方程式为__________
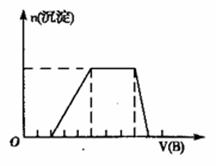
(4)若A是一种溶液,只可能是含有H 、NH4 、Mg2 、Al3 、Fe3 、CO32、SO42- 中的某些离子,当向溶液中加入B溶液时,发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子是 ____________,且各离子的物质的量之比为________________ 。
20.(8分)将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学爱好小组的同学为分析该混合溶液的组成,进行了如下实验:
① 取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
② 另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③ 再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;请根据以上实验中得到的数据分析计算:
⑴ 原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
⑵ 所得混合溶液中c(Cu2 )的取值范围;
⑶ 若要进一步求得混合溶液中c(Cu2 )的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
三、选做题(本题包括3小题,每小题8分,考生只能选做一题。21小题为“化学与技术”内容的试题,22题为“物质结构与性质”内容的试题,23题为“有机化学基础”内容的试题)
21.(8分)科学家猜测“氢能”将是未来最理想的新能源。请回答下列问题:
(1)实验测得,1g氢气燃烧生成液态水放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为 ( )
A.2H2(g) O2(g) = 2H2O(l); △H =-142.9 kJ/mol
B.H2(g) 1/2O2(g) = H2O(l); △H =-285.8 kJ/mol
C.2H2(g) O2(g) = 2H2O(l);△H =-571.6 kJ/mol
D.H2(g) 1/2O2(g) = H2O(g);△H = -285.8 kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2 H2O ![]() CaO 2HBr ②2HBr Hg
CaO 2HBr ②2HBr Hg ![]() HgBr2 H2↑
HgBr2 H2↑
③HgBr2 CaO ![]() HgO CaBr2 ④2HgO
HgO CaBr2 ④2HgO ![]() 2Hg O2↑
2Hg O2↑
上述过程的总反应可表示为 。
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫—碘热循环法),其中用了过量的碘。

请写出反应①的化学方程式: 。
用硫—碘热循环法制取氢最大的优点是 。
(4)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的两点理由 。
22.(8分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为__________。
(2)写出与H2O分子互为等电子体的微粒__________。
(3)水分子在特定条件下轻易得到一个H+,形成水合氢离子(H3O+)。下列对其过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的外形发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
SHAPE \* MERGEFORMAT 

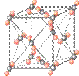

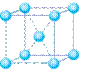
A B C D E
 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
23.(8分)据报道:2007年1月30日107国道湖北孝感段发生危险化学品泄漏, 上百人中毒。经医学诊断为高毒类有机物硫酸二甲酯泄漏引发的人员中毒。该物质在有机合成中用作甲基化试剂(提供-OCH3)。但随着对此研究的深入,该有毒物质的应用范围越来越小,相信不久将被无毒的有机物M完全取代.
现有一种有机香料A是经过有机物M作为甲基化试剂合成的(注重:取代基不能全部相邻)。
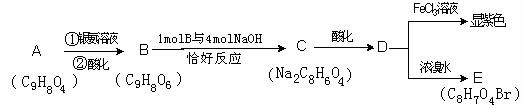
(1)有机物M结构的球棍模型如图所示: ![]()
有机物M的分子式为:
(2)A分子中的官能团的是 ;(除甲氧基外)
(3)根据上述信息 (填可以或不能)确定A的结构式
(4)A可以发生的反应是 (填符号);
a 消去反应 b氧化反应 c 酯化反应 d水解反应
(5)符合题目要求的可能的A的结构简式_______________________
(6)写出下列反应的化学方程式(有机物用结构简式表示)
D → E 反应类型__________________
2008年临沂市高考模拟试卷(二)
化学参考答案
一、选择题(每小题3分,共48分)
1. D 2.B 3.D 4. A 5.D 6.B 7.D 8.A 9.B 10. B 11. B 12. B 13.C
14. C 15. B 16. B
二、必做题(本题包括4小题,共44分)
17. (12分)答案 ⑴溶液显色所需要的时间 ⑵2CO 2NO ![]() N2 2CO2 NO
N2 2CO2 NO
⑶①该研究只能提高化学反应速率,不能使化学平衡发生移动
② ![]() ,减小 = 3 \* GB3 ③ 6g
,减小 = 3 \* GB3 ③ 6g
18.(14分)答案(1)关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗液面高于锥形瓶内液面。静置一会观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气。
(2)SO2 C12 2H2O=SO42- 2C1- 4H (3) ![]()
(4)锥形瓶及导管中的SO2未全部排入到广口瓶中C12完全反应或由于产生SO2速度较快,未与C12反应而排入到NaOH溶液中(其他合理答案也可)
(5)将装置中的SO2全排入到U形管中被吸收 (6)D (7)A 、B 、D。
19. (10分)答案(1)AlO2- 4H =Al3 2H2O (2)SiO2 2NaOH=Na2SiO3 H2O
(3)NH4 HCO3- 2OH-=NH3 2H2O CO32-(4)H 、 NH4 、Al3 、SO42- 2:3:1:4(比例要与前述离子顺序一致)
20.(8分)答案(1)4mol/L (2)0.600 mol/L ≤n (Cu2+) ≤1.50 mol/L (3) 还可测出50.0mL混合溶液中n (Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。
解析:⑴ 解:由I得50.0mL混合溶液中c(Cl-)= 
所以原FeCl3溶液中c(FeCl3)= ![]()
⑵ 解:Ⅱ中加入1.4gFe无固体剩余,即发生的反应为Fe+2Fe3+=3Fe2+
所以50.0mL混合溶液中至少含有Fe3+ ![]()
Ⅲ中加入20.0mL稀硝酸后产生的气体为NO,反生的反应为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
即50.0mL混合溶液中至少含有Fe2+ ![]()
50.0mL混合溶液中根据铁元素守恒有:
n (Fe2+) + n (Fe3+) = 4.0 mol/L×0.05L= 0.20 mol
根据电荷守恒有:3n (Fe3+)+2n (Fe2+)+2n (Cu2+)=n (Cl-)= ![]()
当n (Fe3+) 有最小值时,n (Fe2+)、n (Cu2+)有最大值,且由上述两等式可求得
n (Cu2+)的最大值为0.075 mol
当n (Fe2+)有最小值时,n (Fe3+) 有最大值,n (Cu2+)有最小值,同样可求得
n (Cu2+)的最小值为0.03 mol
所以,50.0mL混合溶液中n (Cu2+)的取值范围为 0.600 mol/L ≤n (Cu2+) ≤1.50 mol/L
⑶ 还可测出50.0mL混合溶液中n (Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。
三、选做题(本题包括3小题,考生只能选做一题,若全做,则只以23题得分。共8分)
21.(1)B (2)2H2O ![]() 2H2↑ O2↑ (3) SO2 I2 2H2O
2H2↑ O2↑ (3) SO2 I2 2H2O ![]() 2HI H2SO4 SO2和I2可循环使用,且无污染。 (4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。)
2HI H2SO4 SO2和I2可循环使用,且无污染。 (4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。)
22.答案(1)1S22S22P4 (2)H2S或NH2-(3)A (4)BC (5)20(6)Cu2 4H2O=[Cu(H2O)4]2
23.答案(1)C3H6O3 (2)醛基和酯基 (3)不能
(4) b d (5) ![]()
(6)
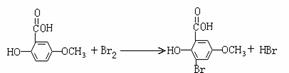 取代反应
取代反应
| |