|
高三年级化学补弱(二)
考点----元素化合物
1、以下关于3He的说法正确的是
A.3He和4He两种核素互为同素异形体 B.3He和4He两种核素互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应D.3He中:质子数=中子数=核外电子数
2、下列有关HF、HCI、HBr、HI的说法错误的是
 A.均为直线型极性分子 B.熔、沸点依次增大 C.稳定性依次减弱 D.还原性依次增强 A.均为直线型极性分子 B.熔、沸点依次增大 C.稳定性依次减弱 D.还原性依次增强
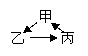
3.下列物质之间的相互转化不符合“ ”(“→”表示一步反应)的是
|
|
甲 |
乙 |
丙 |
|
A |
HCl |
Cl2 |
HClO |
|
B |
Al(OH)3 |
NaAlO2 |
Al2O3 |
|
C |
CH2=CH2 |
CH3CH2I |
CH3CH2OH |
|
D |
NH2CH2COOH |
NH2CH2CONHCH2COOH |
  H2N [ CH2CONHCH2 ] n COOH H2N [ CH2CONHCH2 ] n COOH
|
4.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和
碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③
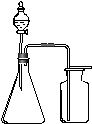 向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸 向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
5.利用下列各组物质制备和收集气体,能采用右图装置的是( )
A. 浓氨水与生石灰反应制NH3 B. 浓盐酸与二氧化锰反应制Cl2
C. 过氧化氢溶液与二氧化锰反应制O2 D. 电石与饱和食盐水反应制C2H2
6.以下物质的制备原理错误的是( )
A. 无水氯化镁的制备 :MgCl 2·6H2O 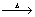 MgCl2 6H2O MgCl2 6H2O
B. 钴的制备:3Co3O4+8Al 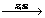 9Co+4Al2O3 9Co+4Al2O3
C. 烧碱的制备:2NaCl 2H2O  2NaOH H2↑ Cl2↑ 2NaOH H2↑ Cl2↑
D. 漂粉精的制备: 2Ca(OH)2 2Cl2→Ca(ClO)2 CaCl2 2H2O
7. 将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用l mol·L-1。的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
8.下列实验方案可行的是
A.鉴别 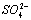 加入BaCl2溶液,再加稀盐酸,观察沉淀是否消失 加入BaCl2溶液,再加稀盐酸,观察沉淀是否消失
B.证实 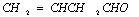 中一定有碳碳不饱和键:滴人KMnO4酸性溶液,看紫红色是否褪去 中一定有碳碳不饱和键:滴人KMnO4酸性溶液,看紫红色是否褪去
C.量取14.80mLlmol·L-1NaOH溶液:选用25mL碱式滴定管
D.检验溶液中一定有CO32-加入稀盐酸,将产生的气体通人澄清石灰水
9.无色的混合气体中,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成为( )
A.NH3、NO2、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2
10.某无色溶液中只可能含有①Na 、②Ba2 、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
|
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
| |
肯定含有的离子是 ,不能确定的离子是
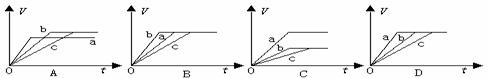
11、等质量的三份锌a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COONa。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是 ( A )
12.(10分)将化学知识系统化,有助于对化学问题的进一步熟悉。请你参与下列关于化学
 反应的讨论。 反应的讨论。
问题1:从不同的角度,化学反应可以有不同的
分类方法,不同类别的化学反应间又有一定的联
系,请在右图的方框中,用图示(每个圆圈代表
一类反应)的方法表示离子反应、化合反应和氧
化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复) |
序号 |
实际生产中采取的措施 |
工业生产实例(各写1个化学方程式) | |
(1) |
通过增大压强提高原料转化率 |
| |
(2) |
使用催化剂增大反应的速率 |
| |