| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
由此可推得,m、n值正确的是 A.m=1,n=1 B.m=1/2,n=1/2 C.m=1/2,n=1 D.m=1,n=1/2 解析:信息给予题。通过观察和分析表中c(H2)、c(Cl2)及v数值之间的关系,求算m、 n的值。第一、第二组数据代入题设公式,得m=1,第二、第三组数据代入题设公式,得n=1/2。答案: D. 【例4】(2004年江苏高考化学题)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s) 2MnO2(s) H2O(l) == Zn(OH)2(s) Mn2O3(s),下列说法错误的是 A.电池工作时,锌失去电子 B.电池正极的电极反应式为:2MnO2(s) H2O(1) 2e— == Mn2O3(s) 2OH—(aq) C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g 解析:该电池的负极反应为Zn(s) 2OH-(aq)-2e— == Zn(OH)2(s),正极反应为2MnO2(s) H2O(1) 2e— ==Mn2O3(s) 2OH—(aq)。Zn为负极,失去电子,电子由负极通过外电路流向正极。1molZn失去2mol电子,外电路中每通过O.2mol电子,Zn的质量理论上减小6.5g。答案为C。 【例5】(2005年广东高考化学题)一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是( ) A.在熔融电解质中,O2-由负极移向正极 B.电池的总反应是:2C4H10 13O2 ==8CO2 10H2O C.通入空气的一极是正极,电极反应为:O2 4e- == 2O2- D.通入丁烷的一极是正极,电极反应为:C4H10 26e- 13O2-==4CO2 5H2O 解析:丁烷燃料电池的总反应为2C4H10 13O2 ==8CO2 10H2O,负极反应为2C4H10 26O2--52e-==8CO2 10H2O,正极反应为13O2 52e-== 26O2-。熔融电解质中,负离子O2-由正极移向负极,正离子由负极移向正极,完成电子运动的循环。答案为B、C。 单元过关测试 一、选择题(本题20个小题,每小题3分,共60分) 1. “可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外现象冰。1体积“可燃冰”可贮载100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是( ) A.“可燃冰”有可能成为人类未来的重要能源 B.“可燃冰”是一种比较洁净的能源 2.已知化学反应2C(S) O2(g) A.12gC所具有的能量一定高于28gCO所具有的能量 B.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量 C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 3.下列物质加入水中,显著放热的是( ) A.生石灰 B.固体NaOH C.无水乙醇 D.固体硝酸铵 4. 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为 据此判定,下列说法中正确的是( ) A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 5.下列变化属于吸热反应的是( ) ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰 A.①④ B.②③ C.①④⑤ D.②④ 6.有人认为人体实际上是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断的补充“燃料”。按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是: A.淀粉类物质 B.水 C.脂肪类物质 D.蛋白质 7.已知2H2(g)+O2(g)===2H2O(l);ΔH=-569.6 kJ·mol-1,2H2O(g)===2H2(g)+O2(g);ΔH=+482.1 kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是( ) A.2.43 kJ B.4.86 kJC.43.8 kJ D.87.5 kJ 8.下列说法正确的是( ) A.需要加热方能发生的反应一定是吸热反应 B.放热的反应在常温下一定很轻易发生 C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 D.吸热反应在一定条件下也能发生 9.下列各装置能构成原电池的是(A C)
10.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.假如把Cu浸入c的盐溶液里,有c的单质析出.据此判定它们的活动性由强到弱的顺序是( ) A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c 11.纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量( ) A.CuSO4溶液 B.ZnSO4 C.铜 D.镁条 12.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( ) A. a电极是负极 B. b电极的电极反应为:4OH--4e-=2H2O +O2↑ C. 氢氧燃料电池是一种具有应用前景的绿色电源 D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 13.已知空气—锌电池的电极反应为:锌片:Zn 2OH—-2e—=ZnO;碳棒: A.正极并被还原 B.正极并被氧化 C.负极并被还原 D.负极并被氧化 14.铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是( ) A.铁水龙头 B.铜水龙头 C.塑料水龙头 D.陶瓷水龙头 15.理论上不能设计为原电池的化学反应是,注:△H<0 为放热反应( ) A.CH4(g) 2O2(g) B.HNO3(aq) NaOH(aq)=NaNO3(aq) H2O(aq);△H<0 C.2H2(g) O2(g) D.2FeCl3(l) Fe(s)==3FeCl2(l);△H<0 16.可逆反应H2(g) I2(g)==I2(g)达到平衡时的标志是( ) A、混合气体密度恒定不变 B、混合气体的颜色不再改变 C、H2、I2、HI的浓度相等 D、I2在混合气体中体积分数不变 17.已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是( ) A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq) B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq) C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq) D.1mol/L稀CH3COOH(aq)和1mol/L稀NaOH(aq) 18.下列各组反应(表中物质均为反应物):刚开始时,放出H2的速率最大的是( )
| 编号
| 金属(粉末状)
| 物质的量(mol)
| 酸的浓度
| 酸的体积
| 反应温度
| A
| Mg
| 0.1
| 6mol/LHNO3
| 10mL
| 60℃
| B
| Mg
| 0.1
| 3mol/LHCl
| 10mL
| 60℃
| C
| Fe
| 0.1
| 3mol/LHCl
| 10mL
| 60℃
| D
| Mg
| 0.1
| 3mol/LHCl
| 10mL
| 60℃ |
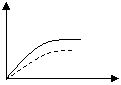
19.将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的
虚线所示。其中正确的是( )
|
损失质量 |
 |
 | ||||||
 | |||||||
 | |||||||
|
损失质量 |
|
损失质量 |
|
损失质量 |
0 t 0 t 0 t O t
A B C D
|
产生H2的速率 |
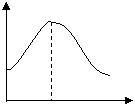 20.把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化
20.把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化
如图所示。下列因素中,影响反应速率的因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度
④Cl—的浓度
A.①④ B.③④
C.①②③ D.②③ t
二、填空题(本题4个小题,共29分)
21.(7分)如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
 (1)实验中观察到的现象是
(1)实验中观察到的现象是
。
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)有此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
22. (6分)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
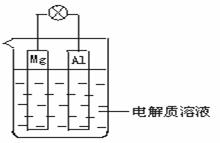
(1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
b.若灯泡不亮,其理由为:_________________________________.
(2)电解质溶液为NaOH(aq)时,灯泡__________(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
b.若灯泡不亮,其理由为:________________________.
23.(4分)将铜片与铝片分别和电流表的“ ”、“-”端相连接,电流表指针调在中间位置。用2个50mL的烧杯,在一个烧杯中注入适量浓硝酸,另一个烧杯中注入0.5mol/L的稀硫酸,回答下列问题:
(1)两极同时插入稀硫酸中,电流计指针偏向 (填“铜”或“铝”)极,铝片上的电极反应式为 。
(2)两极同时插入浓硝酸中,电流计指针偏向 (填“铜”或“铝”)极,此时铝是 极
(填“正”或“负”)。
24.(12分)在200℃时,将amolH2(g)和bmolI2(g)充入到体积为VL的密闭容器中,发生反应:I2(g) H2(g) ![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于C(H2)= ,C(I2)= ,而C(HI)= ,所以化学反应速率 最大,而 最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为C(H2) ,C(I2) ,而C(HI) ,从而化学反应速率ν(正) ,而ν(逆) 。
(3)当反应进行到ν(正)与ν(逆) 时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将 。
三、计算题(本题两个小题,共11分)
25.(6分)在 2 L的密闭容器中, 充入 1 mol N2 和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 填写下列空白:
(1) 平衡时混合气体中三种气体的物质的量比为 _________________.
(2) N2 的转化率为 _______________.
(3) 2分钟内, NH3 的平均反应速率为 _______________.
26.(5分)在一密闭的2L容器中装有4molSO2和2molO2,在一定条件下开始反应。2min末测得容器中有1.6molSO2,请计算:(1)2min末SO3的浓度;(2)2min内SO2的平均反应速率。
参考答案:
一、选择题(本题20个小题,每小题3分,共60分)
1、C 2、A 3、AB 4、A 5、D 6、B 7、A 8、C 9、AC 10、B 11、C 12、B 13、D 14、B 15、B 16、BD 17、B 18、D 19、C 20、C
二、填空题(本题4个小题,共29分)
21.(7分)(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体。(3分)
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。(2分)
(3)Mg 2H+=Mg2+ H2(1分) (4)小于(1分)
22. (6分)(1)亮 a Mg-2e= Mg2+ 2H+ 2e-= H2(2)亮 a 6 H2O 6e-=3 H2 6OH- 2Al-6e- 2OH-=2AlO2 6 H2O(每空均1分)
23.(4分)(1)铝 Al-3e—==Al3+ (2)铜 正 (每空均1分)
24.(12分)(1) ![]()
![]() 0 ν(正) ν(逆)(2)减小 减小 增大 减小 增大 (3)相等 保持不变(每空均1分)。
0 ν(正) ν(逆)(2)减小 减小 增大 减小 增大 (3)相等 保持不变(每空均1分)。
三、计算题(本题两个小题,共11分)
25. (1)2:6:1 (2分) (2)20% (2分) (3)0.1 mol/L·min(2分)
26.(1)1.2mol/L (2分) (2)0.6mol/L·min(3分)
| |