| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
下列计算结果正确的是 A. ①中溶解了5.6gFe B.硝酸的浓度为4mol/L C. ②中溶解了9.6gCu D.④中V=8960 37.将适量的铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3 和Fe2 浓度相等,则已反应的Fe3 和未反应的Fe3 的物质的量之比是 A、2∶3 B、3∶2 C、1∶2 D、1∶1 38.将一定量铁粉和硫粉的温合物隔绝空气共热,充分反应后冷却,再加入足量稀H2SO4,得 到标准状况下的气体11.2L,则原混合物可能的组成是(n代表物质的量) A. C. 39.含n g硝酸的稀溶液恰好和m g铁粉完全反应,若有
40.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2 浓度和加入铁粉的物质的量之间的关系如下图所示(横坐标表示加入铁粉的物质的量)。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 A.1∶1∶1 B.1∶3∶1 C.1∶1∶4 D.3∶3∶8 41.将15 g铁粉溶于1 L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加9 g,则原溶液中硝酸的浓度为 A、1.0 mol·L-1 B、0.8 mol·L-1 C、0.6 mol·L-1 D、0.4 mol·L-1 42.由FeO 、Fe2O3 、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则这种混合物中FeO 、Fe2O3 、Fe3O4的物质的量之比可能为 A、1∶2∶1 B、2∶1∶1 C、1∶1∶1 D、1∶1∶3 43. a mol FeS与b mol FeO投入到V L、C mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 A.(a b)×63g B.(a b)×189g C.(a b)mol D.(CV- 44.高铁酸钾(K2FeO4)是一种新型.高效.多功能水处理剂,是比Cl2.O3.ClO2.KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中: 湿法制备的主要反应方程为: Fe(OH)3 ClO— OH—===FeO42— Cl— H2O 干法制备的主要反应为:FeSO4 Na2O2==Na2FeO4 Na2O Na2SO4 O2↑(均未配平) 下列有关说法不正确的是 A.高铁酸钾中铁显 3价 B.湿法中每生成1 mol Na2FeO4转移3 mol电子 C.干法中每生成1 mol Na2FeO4转移4 mol电子 D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S.NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 45. 在某稀溶液中含1 mol KNO3和4mol H2SO4,向其中加入1.5mol Cu粉,充分反应后产生的气体在标准状况下的体积为 A. 11.2L B. 22.4 L C. 33.6L D. 22.4L~33.6L 之间
A.该反应的氧化剂只有Cu2O B.Cu既是氧化产物,又是还原产物 C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol D.该反应中氧化产物与还原产物的质量比为1∶6 47.在铁与铜的混和物中,加入不足量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是 A.m1一定大于m2 B.m1可能等于m2
48.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是 A.硫酸铜的溶解度 B. 溶液的质量 C.溶液中溶质的质量分数 D.溶液中Cu 49.将23g石英和60gCaCO3在高温下反应,产生的气体在标准状况下的体积为: A.5.6L B.1.2L C.13.44L D.6.72L 50. 纯净的Ca(HCO3)2试样在高温下分解,当剩余固体是原试样质量的一半时,它的分解率为 A.50% B.75% C.92.5% D.100% 51.青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是 A、青石棉是一种易燃品且易溶于水 B、青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2 ·H2O C、1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6L3mol/LHNO3溶液 D、1mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5L2mol/LHF溶液
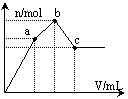 53.向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是 53.向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是
A.a点的溶液呈中性 B.b点发生反应的离子方程式是: Al3 2SO42- 2Ba2 3OH— == Al(OH)3↓ 2BaSO4↓ C.c点加入Ba(OH)2溶液的体积为200 mL D.c点溶液呈碱性 54.向200mL 0.5mol/L的稀硝酸溶液中加入0.54g铝粉,放出448mL (标况) NO气体,经充分反应后,向所得溶液中,加入0.5mol/L NaOH溶液,生成 0.78g沉淀。加入氢氧化钠溶液体积可能为 A.100mL B.150mL C.180mL D.200mL 55.据最新报道,清华才女朱令11年前离奇的铊中毒案,再次引起人们关注。铊盐与氰化钾被列为A级危险品。铊(Tl)的原子序数为81,Tl3 与Ag在酸性条件介质中发生反应:Tl3 2Ag=Tl 2Ag ,Ag Fe2 =Ag Fe3 .下列推断不正确的是 A.Tl 最外层有2个电子 B.氧化性:Tl3 >Fe3 >Ag >Fe2 >Al3 C.还原性:Tl>Fe>Ag D.铊位于第六周期,第IIIA族 56.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ①C(s)+O2(g)===CO2(g);△H1 C(s)+1/2O2(g)===CO(g);△H2 ②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4 ③H2(g)+1/2O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6 ④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8 A.① B.④ C.②③④ D.①②③ 57.已知热化学方程式:SO2(g) 1/2O2(g) A. <196.64kJ B. 196.64kJ/mol C. 196.64kJ D. >196.64kJ 58.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是 A.CH3OH(l) 3/2O2(g) → CO2(g) 2H2O(l) △H= 725.8 kJ/mol B.2CH3OH(l) 3O2(g)→ 2CO2(g) 4H2O(l) △H=-1452 kJ/mol C.2CH3OH(l) 3O2(g)→ 2CO2(g) 4H2O(l) △H=-725.8 kJ/mol D.2CH3OH(l) 3O2(g)→ 2CO2(g) 4H2O(l) △H= 1452 kJ/mol 59.已知:CH4(g) 2O2(g)==CO2(g) 2H2O(1)△H=―Q1 KJ/mol 2H2(g) O2(g)==2H2O(g) △H=―Q2 KJ/mol 2H2(g) O2(g)==2H2O(1) △H = ―Q3KJ/mol 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ A.0.4Q1 0.1Q2 B. 0.4Q1 0.05Q2 C. 0.4Q1 0.1Q3 D.0.4Q1 0.05Q3 60.铅的冶炼大致过程如下: ①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 ③制粗铅:PbO+C A.浮选法富集方铅矿的过程属于化学变化 B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO C.整个冶炼过程中,制取1 molPb共转移2 mol电子 D.将1mol PbS冶炼成Pb理论上至少需要6 g碳 61.将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。.则下列说法不正确的是
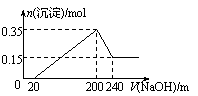 A.镁和铝的总质量为9 g A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸 C.硫酸的物质的量浓度为2.5 mol·L-1 D.生成的氢气在标准状况下的体积为11.2 L 62.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以用投影图表示成:
其中○表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子。试确定在无限长的单链阴离子中(见图),硅原子与氧原子的个数之比为 B A.1:2 B.1:3 C.2:5 D.2:7 63.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2 和Fe3 分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上。其晶体中的阴离子晶胞结构如图示,下列说法不正确的是
B.M的离子位于上述晶胞面心,呈 2价 C.M的离子位于上述晶胞体心,呈 1价,且M+空缺率为50%(体心中没有M+占总体心的百分比) D.晶体的化学式可表示为MFe2(CN)6,且M为 1价 64.有一定质量的KNO3样品,在100C下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在400C下进行时,残留固体质量为120g,700C时为20g。已知KNO3在不同温度下的溶解度:
| 温度
| 100C
| 400C
| 550C
| 700C
| 溶解度
| 20g
| 65g
| 100g
| 140g |
下列对该样品的推断正确的是
A、样品为纯净物 B、样品中混有不溶于水的杂质
C、样品中混有溶解度较大的杂质 D、当温度在550C左右时KNO3完全溶解
65.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?) ![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
|
Ⅰ |
|
Ⅱ |
|
Ⅰ |
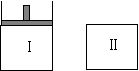 B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
![]()
 66.1798年法国化学家对绿柱石和祖母绿进行化学分析发现了铍。已知绿柱石是一种呈绿色的硅酸盐,可表示为BexAly[SimOn](x、y、m、n均为自然数),其中阴离子部分结构如下图所示(已知 表示硅酸根离子SiO44—),下列说法肯定不正确的是
66.1798年法国化学家对绿柱石和祖母绿进行化学分析发现了铍。已知绿柱石是一种呈绿色的硅酸盐,可表示为BexAly[SimOn](x、y、m、n均为自然数),其中阴离子部分结构如下图所示(已知 表示硅酸根离子SiO44—),下列说法肯定不正确的是
A. 阴离子化学式为:Si6O1612—
B. 绿柱石可用氧化物形式表示为:3BeO·Al2O3·6SiO2
C. 绿柱石可表示为Be3Al2[Si3O12]
D. 绿柱石可溶于强碱和氢氟酸
67.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判定正确的是
A.反应过程中得到6.72L(标准状况)的气体 B.最终得到7.8g的沉淀
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na )=c(Cl-) c(OH-)
68.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
![]() 69.下列表达式错误的是
69.下列表达式错误的是
![]() A.甲烷的电子式:
A.甲烷的电子式:
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子:12 6C
70.人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子“未成对电子”的说法,错误的是
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
71.按第一电离能递增的顺序排列的是
A、Li Na K B、Na Al S C、P Si Al D、Cl Br I
72.下列元素的电负性依次递增的是
A、Na K Rb B、N B Be C、O S Se D、Na P Cl
73.有A、B两种短周期元素,两者能组成A2B3型化合物,已知A的原子序数为n,则B的原子序数可能是
A.n 1 B.n-6 C.n 3 D.n 4
74.两种短周元素X和Y可组成XY2型化合物,则X、Y原子序数差不可能是
 A.1 B.2 C.3 D.4
A.1 B.2 C.3 D.4
75.表示一个原子在第三电子层上有10个电子可以写成
A. 310 B. 3d10 C. 3s23p63d2 D. 3s23p64s2
76.元素R的最高价含氧酸化学式为HnRO2n-2,则在其最低价气态氢化物中,R元素的化合价为
A.-10 3n B.-6 3n C.-12 3n D.-4 2n
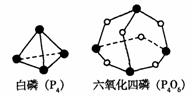
77.化学反应可视为旧键断裂和新键形成的过程。化学键的键能 是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为498kJ·mol—1则P4 3O2==P4O6的反应热△H为
A. 1638 kJ·mol—1 B、-1638 kJ·mol—1 C.-126 kJ·mol—1 D. 126 kJ·mol—1
78.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子最外层均已达到了8电子的结构。则一个三硫化四磷分子中含有的共价键的个数
A、7 B、9 C、19 D、20
79.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
 C.它的分子构型是平面三角形 D.磷原子采用sp2杂化方式
C.它的分子构型是平面三角形 D.磷原子采用sp2杂化方式
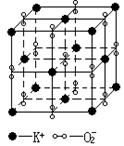
80.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0
价,部分为-2价。下图为超氧化钾晶体的晶胞,下列说法正确的是
A.超氧化钾的化学式为KO2,每个晶胞平均含有4个K+和4个O2-
B.晶体中K+和O2-的配位数均为8 C.晶体中与每个K+距离相等且最近的K+有8个
D.晶体中,0价氧粒子与-2价氧粒子的数目比为3∶1
81.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是
A.X肯定为碱金属元素 B.稳定性:Y的氢化物>Z的氢化物
C.X、Y两元素形成的化合物可能为离子晶体
D.Y、Z两元素形成的化合物熔点较低
83.如图,除氢原子外,采取sp3杂化的原子数为
A .8 B .9 C .10 D.7
84.下列化合物中不属于配合物的是
A.KCl·MgCl2·6H2O B.[Ag(NH3)2] Cl C. KAl(SO4)2·12H2O D.NaAu(CN)2
85. 0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
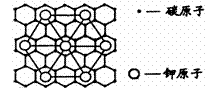 86.石墨能与熔融金属钾作用,形成石墨间隙化合物,
86.石墨能与熔融金属钾作用,形成石墨间隙化合物,
K原子填充在石墨各层面料原子中。比较常见的
石墨间隙化合物是青铜色的化合物,其化学式可
写作CxK,其平面图形见右图,则x值为
A.8 B.12 C.24 D.6
87.NaF,Nal,MgO均为离子化合物,根据下列数据,这 三种化合物的熔点高低顺序是
物质
①NaF
②NaI
③MgO
离子电荷数
1
1
3
![]() m
m
2.31
3.18
2.10
A.①>②>③ B.③>①>② C.③>②>① D.②>①>③
88.食盐晶体如右图所示。在晶体中,· 表示Na ,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na 和Cl-的间距大约是
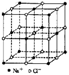
A. ![]() cm B.
cm B. ![]() cm
cm
A. ![]() cm D.
cm D. ![]() cm
cm
89.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是
A.HF、HCI、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次减低
C.F2、C12、Br2、I2的熔、沸点逐渐升高
D.H2S的熔沸点小于H2O的熔、沸点
90.关于晶体的下列说法正确的是
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低
 91.可逆反应aX(g) bY(g)
91.可逆反应aX(g) bY(g) ![]() cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
92.在2L密闭容器中进行如下反应:mX(g) nY(g) ![]() pZ(g) qQ(g),2s时间内X表示的平均反应速率为0.3mpmol/(L·s),则2s时间内,Q物质增加的物质的量为
pZ(g) qQ(g),2s时间内X表示的平均反应速率为0.3mpmol/(L·s),则2s时间内,Q物质增加的物质的量为
A.1.2qpmol B.1.2mpmol C.1.6pqmol D.0.6qpmol
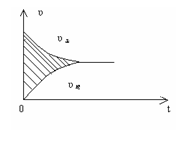 93.容积固定的2L密闭容器中进行的某一可逆反应
93.容积固定的2L密闭容器中进行的某一可逆反应
A(g) 2B(g) ![]() 2C(g),以B的物质的量浓度改变表示的反应
2C(g),以B的物质的量浓度改变表示的反应
速度v(正),v(逆)与时间的关系图如所示。已知反应速率v的
单位为mol·L-1·s-1,则图中阴影部分的面积可表示
A.A的物质的量浓度的减少 B.B的物质的量浓度的减少
C.C的物质的量增加 D.B的物质的量减少
94.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g) 2B(g) ![]() 2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b- ![]() )
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
95.某恒温恒容容器中,建立如下平衡:2A(g) ![]() B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
96.在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:
2NO2 ![]() N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x<y C.x=y D.不能确定
97.下列关于化学反应的自发性叙述中正确的是
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D熵变小于0而焓变大于0的反应肯定是自发的
98.某密闭容器中进行如下反应:X(g) 2Y(g) ![]() 2Z(g),若最初时只加入X、Y两种物质,要使平衡时反应物总物质的量与生成物的物质的量相等,则x、Y的初始物质的量之比
2Z(g),若最初时只加入X、Y两种物质,要使平衡时反应物总物质的量与生成物的物质的量相等,则x、Y的初始物质的量之比 ![]() 的范围应满足C
的范围应满足C ![]()
99.密闭容器中进行如下反应: X2(气) Y2(气) ![]() 2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
A. Z 为 0.3 mol/L B. Y2 为 0.35 mol/L C. X2 为 0.2 mol/L D. Z 为 0.4 mol/L
100.已知N2(g) 3H2(g) ![]() 2NH3(g);△H=-92.4kJ/mol。恒温、恒压下容积可变的容器中充入2摩N2和8摩H2,平衡时生成1摩NH3,现在相同条件下的同一容器中充入x mol N2 y mol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、 y的值为 c
2NH3(g);△H=-92.4kJ/mol。恒温、恒压下容积可变的容器中充入2摩N2和8摩H2,平衡时生成1摩NH3,现在相同条件下的同一容器中充入x mol N2 y mol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、 y的值为 c
A.1.5、6.5 B.2、8 C.5、21 D.3、13
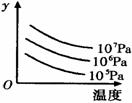 101.某可逆反应L(s) G(g)
101.某可逆反应L(s) G(g) ![]() 3R(g); △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判定图中y轴可以表示
3R(g); △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判定图中y轴可以表示
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
102.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应;
A 3B ![]() 2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是
2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是
①原混合气体的体积为1.2VL,②原混合气体的体积为1.1VL,③反应达平衡时气体A消耗掉0.05VL,④反应达平衡时气体B消耗掉0.05VL。
A.②③ B.②④ C.①③ D.①④
103.在一定条件下化学反应:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-197kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应 放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应 放出的热量(Q)如下表所列:
容器
SO2(mol)
O2(mol)
N2(mol)
Q(kJ)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以上数据,下列叙述不正确的是
A.Q1=2Q2=2Q3=197
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
104.用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是
A、配制标准溶液的NaOH中混有Na2CO3杂质
B、滴定终点读数时,俯视滴定管的刻度,其他操作正确
C、盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D、滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
105.向VmLBaCI2溶液中加入一定体积的0.05 mol·L-1的硫酸溶液,两者恰好完全反应,且反应后的溶液的pH为3.0,则原BaCI2溶液的物质的量浓度是
A. 5.05×10-4 mol·L-1 B. 5.05×10-3 mol·L-1
C. 1.01×10-4 mol·L-1 D. 1.01×10-3 mol·L-1
106.将0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A. c(CH3COO-) >c(Cl-) >c(H )>c(CH3COOH)
B. c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H )
C. c(CH3COO-)=c(Cl-)>c(H )>c(CH3COOH)
D. c(Na )+c(H )=c(CH3COO-)+c(Cl-)+c(OH-)
107.在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH=7(设溶液反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K ) B.c(H )=c(OH‑)<c(K )<c(A-)
C.V总≥20mL D.V总≤20mL
108. 0.02mol·L-1的HCN溶液与0.02mol·L-1NaCN溶液等体积混合,已知混合溶液中c(CN-)﹤c(Na ),则下列关系中,正确的是
A、c(Na )﹥c(CN-)﹥(OH-)﹥c(H ) B、c(HCN) c(CN-)=0.04mol·L-1
C、c(Na ) c(H )=c(CN-) c(OH-) D、c(CN-)﹥c(HCN)
109.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3 )=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K )为:
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
110.一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) ![]() Ba2 +2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是
Ba2 +2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是
A.溶液中钡离子数目减小 B.溶液中钡离子浓度减少
C.溶液中氢氧根离子浓度增大 D.PH减小
111.将足量BaCO3分别加入: = 1 \* GB3 ① 30mL 水 = 2 \* GB3 ②10mL 0.2mol/LNa2CO3溶液 = 3 \* GB3 ③50mL 0.01mol/L 氯化钡溶液 = 4 \* GB3 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2 的浓度由大到小的顺序为
A.①②③④ B..③④①② C.④③①② D.②①④③
112.将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是
A、c(NH4 )=c(Na )=c(OH-)>c(NH3·H2O)
B、c(NH4 )=c(Na )>c(NH3·H2O)>c(OH-)>c(H )
C、c(NH4 )>c(Na )>c(OH-)>c(NH3·H2O)
D、c(NH4 )>c(Na )>c(NH3·H2O)>c(OH-)>c(H )
113.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4 10OH--8e-=CO32- 7H2O
③负极上是O2获得电子,电极反应式为 O2 2H2O 4e-=4OH-
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
114.在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-。该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物和还原产物的质量比为
A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5
115.为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是
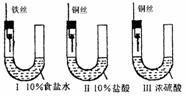 A.装置Ⅰ左侧的液面一定会上升
A.装置Ⅰ左侧的液面一定会上升
B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重
D.装置Ⅲ中的铁钉几乎没被腐蚀
116.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“ ”,另一个接线柱旁标有“一”。关于标有“一”的接线柱的说法中正确的是
A.充电时作阳极,放电时作负极 B.充电时作阴极,放电时作正极
C.充电时作阳极,放电时作正极 D.充电时作阴极,放电时作负极
117.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移2mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
118.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A 可用铁作阳极材料 B 电解过程中阳极四周溶液的pH升高
C 阳极反应方程式为:2Cl--2e-=Cl2
D 1mol二价镍全部转化为三价镍时,外电路中通过1mol电子
 119.如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H )和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是
119.如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H )和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是
A.左边的电极为电池的负极,a处通入的是甲醇
B.右边的电极为电池的负极,b处通入的是空气
C.电池负极的反应式为:CH3OH H2O-6e-=CO2 6H
D.电池的正极反应式为:O2 2H2O 4e-=4OH-
120.在相同温度下,等体积等物质的量浓度的下列4种稀溶液:①Na2S,②H2SO3,③NaHSO3,④Na2SO4中所含带电微粒数由多到少的顺序是
A. ①>④>②>③ B.④>①>③>② C. ①>④>③>② D. ④>①>②>③
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
A |
B |
C |
A |
AB |
C |
A |
B |
AB |
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
A |
B |
C |
C |
D |
B |
C |
C |
B |
A |
|
题号 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
答案 |
BC |
D |
C |
A |
A |
C |
B |
A |
B |
AC |
|
题号 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
答案 |
B |
B |
C |
AD |
B |
BD |
A |
D |
CD |
C |
|
题号 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
|
答案 |
B |
CD |
BD |
AC |
B |
D |
A |
C |
C |
D |
|
题号 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
答案 |
BC |
C |
D |
AC |
B |
C |
A |
B |
D |
D |
|
题号 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
|
答案 |
D |
B |
B |
BD |
CD |
AC |
BC |
C |
C |
BD |
|
题号 |
71 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
|
答案 |
B |
D |
AC |
D |
C |
C |
B |
B |
A |
AD |
|
题号 |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
90 |
|
答案 |
CD |
AD |
C |
AC |
B |
A |
B |
B |
CD |
A |
|
题号 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
|
答案 |
D |
A |
B |
C |
B |
A |
A |
C |
AB |
C |
|
题号 |
101 |
102 |
103 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
|
答案 |
C |
A |
A |
AD |
A |
BD |
AD |
AC |
C |
A |
|
题号 |
111 |
112 |
113 |
114 |
115 |
116 |
117 |
118 |
119 |
120 |
|
答案 |
B |
D |
A |
C |
B |
D |
A |
CD |
AC |
C |
| |