|
高三年级化学补弱复习题(一)
姓名 2008-12-1
一.离子方程式
判定正误,并写出正确的离子方程式。
1.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2 SO42—=BaSO4↓
2.碳酸氢钠溶液与少量石灰水反应:2HCO3— Ca2 2OH—=CaCO3↓ CO32- 2H2O
碳酸氢钠溶液与过量石灰水反应:
3.向氯化铝溶液中加入过量氨水:A13 4NH3·H2O  A1O2— 4NH4 2H2O A1O2— 4NH4 2H2O
4.NH4HCO3溶液与过量NaOH溶液混合后加热:NH4 OH—=NH3↑ H2O
5.澄清石灰水与盐酸反应:H OH-=H2O
6.过量的C12通入FeCl2溶液中:Fe2 C12=Fe3 十2Cl-
7. 稀硝酸中加入过量的铁粉:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
8. 4 mol/L的NaAlO2溶液和7 mol/L的HCI等体积互相均匀混合:
4AlO2- 7H H2O  3Al(OH)3↓ Al3 3Al(OH)3↓ Al3
9.氢氧化钡溶液与稀硫酸反应:Ba2 OH- H SO42-== BaSO4 ↓ H2O
10.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 :Fe2 2H H2O2== Fe3 2H2O
碳酸钙与盐酸反应 CaCO3 2H == Ca2 CO2↑ H2O
11. 盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
二. 大量共存
12.下列各组离子一定能大量共存的是( )
A.在含大量Fe3 的溶液中:NH4 、Na 、Cl-、SCN-
B.使酚酞试液变红的溶液中:Na 、K 、AlO2-、CO32-
C.在c(OH-) =10—13mol/L 的溶液中:NH4 、Al3 、SO42-、NO3-
D.在pH =1的溶液中:K 、Fe2 、Cl-、NO3-
13. 下列各组离子在溶液中能大量共存,加入Fe2(SO4)3后仍能大量共存的是( )
A. Na+、I-、CO32-、ClO- B. Fe2+、H+、K+、NO3-
C. Ba2+、Na+、SCN-、Cl- D. Cu2+、Mg2+、Cl-、NO3-
三、设 NA 为阿伏伽德罗常数,下列叙述正确的是( )
15. 在标准状况下,22.4 L NO 与11.2 L O2 充分反应后,所得气体的分子数为 NA
16.常温常压下,1 mol 氩气所含的原子个数为 NA
17. 1 L 1 mol/L 的FeCl3 溶液中含有三价铁离子数目为 NA
18. 标准状况下,1 L 辛烷完全燃烧所生成气态产物的分子数为 8/22.4 NA
19.3.6 g重水中所含质子数为2NA
20.1 mol S与足量Cu反应生成Cu2S转移NA个电子
21.1 mol CH4分子中共价键总数为4 NA
22.4.48 L N2所含分子数为0.2 NA
23.将22.4L标况下的氯气在一定条件下与足量铁丝充分反应,转移的电子数为2NA
24.标准状况下,22.4L丙烷中共价键总数为10NA
25.标准状况下,22.4LCO2和O2的混合气体中所含的氧原子总数为2NA
26.1L浓度为lmol·L-1的Na2CO3溶液中含有NA个CO32-
27.0.3mol Fe粉与足量水蒸气反应生成的H2分子数为0.4NA
28.在标准状况下,V升 SO3含氧原子个数是3V/22.4
四、电化学
29.某溶液含有NaCl和H2SO4两种溶质,它们的物质的量之比为2∶1。用石墨作电极电解该混合溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是
A.阴极始终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段是电解水 D.溶液的pH不断增大,最后pH大于7
30.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
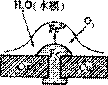 A.负极电极反应式为:Fe-3e-=Fe3 A.负极电极反应式为:Fe-3e-=Fe3
B.此过程中还涉及到反应:4Fe(OH)2 2H2O O2=4Fe(OH)3
C.此过程中铜并不被腐蚀 D.此过程中电子从Fe移向Cu
31. LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4 Li e-==LiFePO4 负极 Li-e-== Li
下列说法中正确的是
A.充电时电池反应为FePO4 Li = LiFePO4
B.充电时动力电池上标注“ ”的电极应与外接电源的正极相连
C.放电时,在正极上是Li+得电子被还原
D.放电时电池内部Li 向负极移动
32. 某同学按右图所示的装置进行电解实验。下列说法正确的是( )
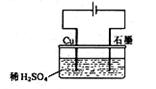 A.电解过程中,铜电极上有H2产生 A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu H2SO4  CuSO4 H2↑ CuSO4 H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度一直会不断增大
33. 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li 3SOCl2=6LiCl Li2SO3 2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2 被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
34.金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2 <Ni2 <Cu2 ),下列叙述正确的是 ( )
A.阳极发生还原反应,其电极反应式:Ni2 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的阳离子只有Fe2 和Zn2
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
|