|
高三化学第一学期期中考试
试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页,满分100分,考试时间90分钟。
第Ⅰ卷(选择题 共46分)
注重事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、考试科目、试卷类型用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Mn 55 Cu 64
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1.某实验室由于治理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是
A.KMnO4 B.NaCl C.(NH4)2SO4 D.CH3COOH
2.CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料与干冰都是纯净物
D.聚二氧化碳塑料的使用会产生白色污染
3.据报导,2002年10月26日,俄罗斯特种部队在解救人质时,除使用了非致命武器芬太奴外,还使用了一种麻醉作用比吗啡强100倍的氟烷。已经氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有
A.1种 B.2种 C.3种 D.4种
4.等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB VC,则在C的生成物中,该金属元素的化合价为
A. 1 B. 2 C. 3 D. 4
5.在通常条件下,下列各组物质的性质排列不正确的是
A.熔点:CO2<KCl<SiO2
B.沸点:乙烷>戊烷>2—甲基丁烷
C.密度:苯<水<1,1,2,2—四溴乙烷
D.热稳定性:HF>HCl>H2S
二、选择题(本题包括12小题,每小题3分,共36分。每小题只有一个选项符合题意)
6.NA代表阿伏加德罗常数,下列说法正确的是
A.80mL10mol·L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
7.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构。则一个三硫化四磷分子中含有的共价键个数是
A.7个 B.9个 C.19个 D.不能确定
8.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应的气态氢化物的稳定性C>D;E是这五种元素的简单离子中半径最小的。则它们的原子序数由小到大的顺序是
A.B,A,C,D,E tx B.A,E,B,C,D
C.E,B,A,C,D tx D.B,A,E,D,C
9.某二元弱酸(H2A)溶液按下式发生一级和二级电离:
H2A  H HA- H HA-
HA-  H A2- H A2-
已知相同浓度时的电离程度:H2A大于HA-,则c(H2A)最大的是
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02mol·L-1的HCl溶液与0.04mol·-1的NaHA溶液等体积混合
D.0.02mol·L-1的NaOH溶液与0.02mol·L-1的NaHA溶液等体积混合
10.某有机物A的化学式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有
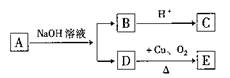
A.2种 B.3种 C.4种 D.5种
11.可用于鉴别以下三种化合物的一组试剂是
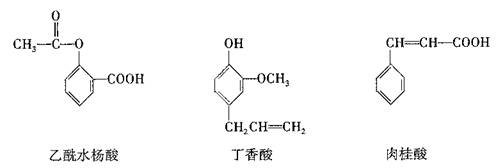
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.①与② B.①与④ C.②与③ D.③④
12.下列离子方程式正确的是
A.用石墨作电极电解饱和食盐水:2Cl- 2H2O  Cl2↑ H2↑ 2OH- Cl2↑ H2↑ 2OH-
B.石灰石溶于醋酸:CaCO3 2H =Ca2 CO2↑ H2O
C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2 OH- H SO2-4=BaSO4↓ H2O
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2 HCO-3 OH-=CaCO3↓ H2O
13.“西气东输”工程使东部发达地区的居民离别了管道煤气用上了天然气。已知某管道煤气的主要成分是H2和CO,天然气的主要成分是CH4,它们燃烧的热化学方程式为:
2H2(g) O2(g)=2H2O(1);ΔH=-571.6kJ/mol
2CO(g) O2(g)=2CO2(g);ΔH=-566kJ/mol
CH4(g) 2O2(g)=CO2(g) 2H2O(1);ΔH=-890.31kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的可燃气体,理论上所获得的热量,后者大约是前者的多少倍
A.1.3 B.1.6 C.3.1 D.0.8
14.对可逆反应4NH3(g) 5O2(g)  4NO(g) 6H2O(g),下列叙述正确的是 4NO(g) 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
15.下列有关实验或原理的叙述,正确的是
A.用分液漏斗进行分液操作,将甘油和水的混合物分离
B.将未经湿润的pH试纸浸到某溶液中,取出与标准比色卡比较,测溶液的pH
C.测定中和反应热时,测量完酸溶液的温度后,温度计应用蒸馏水洗净
D.将少量浓溴水滴入苯酚和苯的混合液中,以除去苯酚
16.向1mol赤热的Cu2S通入足量水蒸气,充分反应后生成2mol氢气,则Cu2S应转化成
A.Cu和SO2 B.Cu和S
C.CuO和SO2 D.CuO和S
17.t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g·cm-3)相同浓度的KCl溶液。现将甲烧杯中的溶液蒸发掉35.0gH2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g。下列说法正确的是
A.原溶液的质量分数为20%
B.t℃时,KCl的溶液度为50.0g
C.原溶液的物质的量浓度为3.0mol·L-1
D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
第Ⅱ卷(非选择题 共54分)
注重事项:
1. 第Ⅱ卷共4页,用钢笔或圆珠笔将答案直接答在试题卷上。
2. 答卷前先将密封线内的项目填写清楚。
三、(本题包括1小题,共17分)
18.(17分)某化学研究性学习小组讨论Fe3 和SO2-3之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3 SO2-3 H2O=2Fe2 SO2-4 2H ;二是发生双水解反应:2Fe3 3SO2-3 6H2O=2Fe(OH)3(胶体) 3H2SO3。为了证实是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是_______________________。
实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是_________________________________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为__________________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是_______________________________________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。由上述实验得出的结论是______________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
四、(本题包括2小题,共22分)
19.(8分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO2-4和N4H4 4两种离子形式存在,植物的根系极易吸收N4H4 4,但它碰到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2__________(填“能”或“不能”)和草木灰混合施用;
(3)已知白磷、NH 4、N4H4 4的空间构型均为四面体,NH 4的结构式为 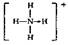 (→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 (→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 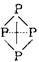 。 。
请画出N4H4 4的结构式_____________________________。
(4)已知液氨中存在着平衡2NH3  NH 4 NH-2。科学家在液氨中加入氢氧化铯(CsOH)和非凡的吸水剂,使液氨中的NH4 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________________。 NH 4 NH-2。科学家在液氨中加入氢氧化铯(CsOH)和非凡的吸水剂,使液氨中的NH4 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________________。
20.(14分)下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。
已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
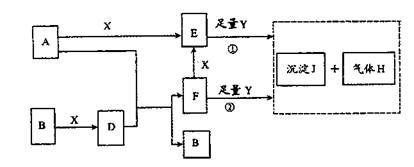
(1)化学式:B为___________,F为_____________;
(2)写出D的电子式___________,液态D能否导电_______________(填“能”或“否”);
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号)_______________;
a.直接与氧气发生化学腐蚀
b.通过原电池反应发生腐蚀
c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:______________________________________________________;
(4)已知H的密度约是空气密度的1.1倍,则①中所涉及的反应的化学方程式为:
__________________________________,_______________________________。
五、(本题包括1小题,共8分)
21.(8分)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。 |
烯类化合物 |
相对速率 | |
(CH3)2C=CHCH3 |
10.4 | |
CH3CH=CH2 |
2.03 | |
CH2=CH2 |
1.00 | |
CH2=CHBr |
0.04 | |