考点解析复习专题辅导1.氧化还原反应及其配平
1.复习重点:1、氧化还原反应概念。
2、电子守恒原理的应用。
3、根据化合价升降总数守恒配平化学反应方程式。
2.难点聚焦
氧化还原反应中的概念与规律:
一、 五对概念
在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是:
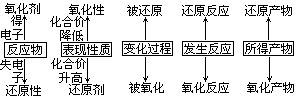
二、 五条规律
1、表现性质规律
同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
2、性质强弱规律
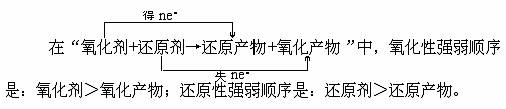
3、反应先后规律
在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2
4、价态归中规律
含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
5、电子守恒规律
在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
三.物质氧化性或还原性强弱的比较:
(1)由元素的金属性或非金属性比较
<1>金属阳离子的氧化性随其单质还原性的增强而减弱

非金属阴离子的还原性随其单质的氧化性增强而减弱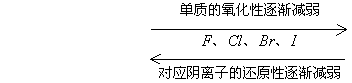
(2)由反应条件的难易比较
不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如:
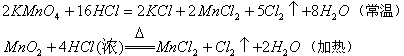
前者比后者轻易发生反应,可判定氧化性: ![]() 。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
(3)根据被氧化或被还原的程度不同进行比较
当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如 ![]() ,根据铁被氧化程度的不同
,根据铁被氧化程度的不同 ![]() ,可判定氧化性:
,可判定氧化性: ![]() 。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
(4)根据反应方程式进行比较
氧化剂 还原剂=还原产物 氧化产物
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
(5)根据元素周期律进行比较
一般地,氧化性:上>下,右>左;还原性:下>上,左>右。
(6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关:
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如中性环境中 ![]() 不显氧化性,酸性环境中
不显氧化性,酸性环境中 ![]() 显氧化性;又如
显氧化性;又如 ![]() 溶液的氧化性随溶液的酸性增强而增强。
溶液的氧化性随溶液的酸性增强而增强。
注重:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性: ![]() ,氧化性:
,氧化性: ![]() 。
。
3.例题精讲:
一、氧化还原反应中的概念辨析:
例1、(2000广州测试题)制备氰化钙的化学方程式为
CaCO3 2HCN = Ca(CN)2 CO↑ H2↑ CO2↑,在反应中( )
A. 氢元素被氧化,碳元素被还原
B. HCN既是氧化剂又是还原剂
C. Ca(CN)2是氧化产物,H2 是还原产物
D. CO为氧化产物,H2 为还原产物
解析:本题考查氧化还原反应的有关概念。
CaCO3 2HCN = Ca(CN)2 CO↑ H2↑ CO2↑(注重生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。答案:B、C。
点评:此类结合实例确定氧化还原反应的有关概念的试题,其解题方法是:找变价 ![]() 判类型
判类型 ![]() 分升降
分升降 ![]() 定其他。其中“找变价”是非常要害的一步,非凡是反应物中含有同种元素的氧化还原反应(如本题反应物均含有碳元素),必须弄清它的变化情况。
定其他。其中“找变价”是非常要害的一步,非凡是反应物中含有同种元素的氧化还原反应(如本题反应物均含有碳元素),必须弄清它的变化情况。
例2. (1997年全国高考题)下列叙述正确的是( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
解析:本题主要是考查氧化还原反应概念正误的判定。
答案:A、D。
点评:解此类有关概念辨析的试题应遵循“理解概念抓实质”的原则,若是再辅以具体实例,会使抽象的问题具体化,其判定结果更具有可靠性。
例3:(98高考试测题)120℃、101.3KPa条件下,有2LH2O、2LCO、1LCO2、0.5LO2和1LH2组成的混合气体。将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
⑴尾气是否有可能是单一气体? (填“可能”或“不可能”)。若可能,该气体是
⑵原气体中是否有几种(或一种),不可能再存在于尾气之中: (填“有”或“没有”。若有,它们(或它)是 。
⑶原气体中是否有几种(或一种)肯定存在于尾气中? (填“有”或“没有”。若有,它们(或它)是 。
解答:题时若将放有足量Cu粉、C粉和CuO粉的三个反应管排列组合,共有6种情况,逐一分析,固然可以求解,但相当费时费力。如运用发散思维从还原剂Cu粉、C粉可将O2、CO2、H2O还原成CO、H2;氧化剂CuO可将CO、H2氧化成CO2、H2O等角度来考虑,就能找到一个新角度,发现新的解法:
反应管盛放物质
可吸收气体
能反应产生新气体
灼热Cu粉(还原剂)
O2
无
灼热C粉(还原剂)
CO2、H2O、O2
CO、H2
灼热CuO粉(氧化剂)
CO、H2
CO2、H2O
不难发现Cu粉、C粉和CuO粉的三个反应管无论如何排列,O2一定不再存在,尾气之中有CO2、H2O或CO、H2存在。
答案:⑴不可能 ⑵有,O2 ⑶没有
二、氧化性或还原性强弱判定:
例4. (1998年上海高考试题)根据下列反应判定有关物质还原性由强到弱的顺序是( )
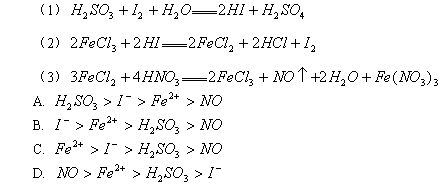
解析:本题是根据物质氧化性或还原性强弱的规律解题。在同一氧化还原反应中,氧化剂 还原剂=还原产物 氧化产物,还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物,概括为:左>右。据此规律,由反应式(1)可知还原性 ![]() ,由(2)可知还原性
,由(2)可知还原性 ![]() ,由(3)可知还原性
,由(3)可知还原性 ![]() 。综合(1)(2)(3)得:
。综合(1)(2)(3)得: ![]() 。答案:A
。答案:A
例5. (2000年南京调研试题)已知 ![]() 均有还原性,它们在酸性溶液中还原性的强弱顺序为
均有还原性,它们在酸性溶液中还原性的强弱顺序为 ![]() 。则下列反应不能发生的是( )
。则下列反应不能发生的是( )
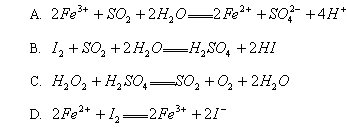
解析:本题实质上是例3的逆向思维题,解题时可先假设各选项反应均能发生,推出选项中相应微粒还原性的强弱顺序,然后对照已知微粒还原性强弱顺序,从而确定反应能否发生。
由还原性强弱顺序的判定规律可知,各选项有关微粒还原性强弱顺序为:A. ![]() ,对比
,对比 ![]() ,C、D与此相违反,故C、D反应不能发生。
,C、D与此相违反,故C、D反应不能发生。
答案:C、D。
点评:氧化还原反应能否发生,其规律是:强氧化剂 强还原剂 ![]() 弱氧化剂 弱还原剂,或者说氧化性、还原性体现“以强制弱”的原则。根据氧化还原反应,判定有关微粒的氧化性、还原性的强弱是化学中的一条重要规律的应用,也是高考考查的热点知识。
弱氧化剂 弱还原剂,或者说氧化性、还原性体现“以强制弱”的原则。根据氧化还原反应,判定有关微粒的氧化性、还原性的强弱是化学中的一条重要规律的应用,也是高考考查的热点知识。
三、 氧化还原反应方程式配平:
1、配平原则:在氧化还原反应元素间得失电子总数(或化合价升降总数)相等。
2、配平方法:一标、二找、三定、四平、五查
(1) 定项配平:
例5、(03年上海高考试题)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判定空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
解答:根据元素间化合价升降总数相等得:(1)+1 (2)CuI 0.5
(3)2 5 2 1
(2) 缺项配平:
例6、(上海高考试题)KClO3 HCl(浓)→ KCl ClO2↑ Cl2↑ A
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是 (填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍。
解析:(1)HCl中一部分Cl-化合价不变,表现为酸性,一部分Cl-化合价升高到+1价,表现为还原性,KClO3化合价降低到+4价。先配平发生元素化合价变化的系数,观察得缺项为H20。配平得2、4、2、2、1、2 H20。(2) ②、(3)0.2 (4)根据得电子能力: ![]() :
: ![]() =2.63
=2.63
(3) 依题意书写氧化还原反应方程式:
例7、在KI和H2SO4 溶液中加入H2O2 ,放出大量不溶于水的无色气体(气泡从溶液内部放出),同时溶液呈紫红色,且可使淀粉变蓝,写出化学方程式.
解析:这是一道颇为简单但却很轻易出错的化学题,错误的原因大多是把实验现象看成只是一个反应的现象,其实,实验现象往往是若干个反应共同体现出来的,该题就是如此.有的同学认为产物中有I2 和O2 ,这没有错,但假如认为这两种物质均是由一个反应得到的话,这就错了,因为在这个反应中,这两种物质均是氧化产物,哪么还原剂是什么呢?假如还原剂是H2SO4 ,则应该有SO2生成,与题意不符,而且稀H2SO4 也没有这么强的氧化性.
H2O2 2KI H2SO4 =I2 K2SO4 2H2O
2H2O2 =2H2O O2 ↑
点评:解此类题方法是:先依据题意设法找出发生氧化还原反应的物质,根据元素化合价变化总数守恒配平其系数,再根据电荷、元素守恒配平找出并其它物质。
4.实战演练
1、[03年上海高考试题]是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A 1:1 B 2:1 C 1:2 D 2:3
2. [2000年天津调考试题]对于反应 ![]() 的正确说法是( )
的正确说法是( )
A. 属于置换反应 B. ![]() 是还原剂
是还原剂
C. ![]() 是还原剂 D.
是还原剂 D. ![]() 既是氧化产物又是还原产物
既是氧化产物又是还原产物
3. [2000年福州测试题]常温下,在下列溶液中发生如下反应:
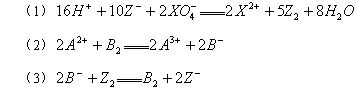
由此判定,下列说法错误的是( )
A. 反应 ![]() 可以进行
可以进行
B. Z元素在(1)(3)反应中均被还原
C. 氧化性由强到弱顺序是 ![]()
D. 还原性由强到弱顺序是 ![]()
4. [1999年长沙联考试题]今有下列三个氧化还原反应:
若某溶液中有 ![]() ,可加入的试剂是( )。
,可加入的试剂是( )。
![]()
5. [2001年南昌测试题] 五种物质 ![]() ,它们是硫及其化合物,已知在一定条件下有如下转化关系(未配平):
,它们是硫及其化合物,已知在一定条件下有如下转化关系(未配平):
![]()
则这些物质中硫元素的化合价或平均化合价由低到高的顺序是( )
![]()
6. [2001年全国高考试题] 某金属与足量的稀硫酸反应,生成该金属的三价正盐和 ![]() 氢气。则该金属的相对原子质量为( )
氢气。则该金属的相对原子质量为( )
![]()
7. [2001年全国高考试题]已知在酸性溶液中,下列物质氧化 ![]() 时,自身发生如下变化:
时,自身发生如下变化:
![]()
假如分别用等物质的量的这些物质氧化足量的 ![]() ,得到
,得到 ![]() 最多的是( )
最多的是( )
![]()
8. [1999年上海高考试题]某温度下,将 ![]() 通入
通入 ![]() 溶液中,反应得到
溶液中,反应得到 ![]() 的混合液,经测定
的混合液,经测定 ![]() 的浓度之比为1:3,则
的浓度之比为1:3,则 ![]() 与
与 ![]() 溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A. 21:5 B. 11:3 C. 3:1 D. 4:1
9. [1997年全国高考试题]某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是( )
![]()
10[2003年江苏高考试题]在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A +4 B +5 C +6 D +7
11、(2003南京测试题)已知IBr的性质与卤素相似, ![]() 的结构为
的结构为 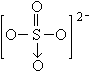 ,
, ![]() 的结构为
的结构为  ,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是 ( )
,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是 ( )
①IBr ![]() =HIO HBr ②
=HIO HBr ② ![]() 2
2 ![]() =S¯
=S¯ ![]()
![]()
③ ![]() 4
4 ![]() 2
2 ![]() =2
=2 ![]() 5
5 ![]() ④ 2HOF=2HF
④ 2HOF=2HF ![]()
A、①②③④ B、只有②③④ C、只有④ D、只有②
12. (2003北京测试题) 保险粉是连二亚硫酸钠( ![]() )的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入
)的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入 ![]() 气体,所发生的化学反应是:HCOONa 2
气体,所发生的化学反应是:HCOONa 2 ![]() NaOH=
NaOH= ![]()
![]()
![]() ,以下有关叙述中错误的是 ( )
,以下有关叙述中错误的是 ( )
A、在此反应中,HCOONa是还原剂, ![]() 是氧化剂
是氧化剂
B、保险粉的还原性比HCOONa的还原性强
C、NaOH未被氧化也未被还原
D、甲醇虽未参加反应,但有助于保险粉的结晶、分离
13.(2003高考试测题)油画所用颜料含有某种白色的铅化合物,置于空气中,天长日久就会生成黑色PbS,从而使油画的色彩变暗。若用H2O2来“清洗”,则可将PbS转变为白色的PbSO4而使油画“复原”。请填空: = 1 * GB3 ①上述“清洗”反应的化学方程式为
= 2 * GB3 ②若有0.1mol 的PbS参与反应,则在此反应中发生转移的电子 为 mol
14. (2003淮安测试题) 在热的稀硫酸溶液中溶解了11.4gFeSO4。当加入50ml0.5mol/LKNO3溶液后,使其中的Fe2 全部转化成Fe3 ,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeSO4 KNO3 H2SO4 → K2SO4 Fe2(SO4)3 NxOy H2O
(1)推算出x= y= 。
(2)配平该化学方程式(系数填写在上式方框内)。
(3)反应中氧化剂为 。
(4)用短线和箭头标出电子转移的方向和总数。
15.(2003南通市四县联考)化学实验中,假如使某步骤中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
![]()
![]() Na2Cr2O7—①→CrCl3—②→Cr(OH)3
Na2Cr2O7—①→CrCl3—②→Cr(OH)3
⑤ ④ ③↓
Na2CrO4←————— NaCrO2
(1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中有一种难溶物质既能与强酸反应,又能与强碱反应写出相关离子反程式 、 。
(3)步骤①是重铬酸钠与碘化钾在盐酸存在下的反应,产物是三氯化铬、碘单质等,请写出化学方程式并配平
16. (2003淮安测试题)已知氧化性Cl2>Br2>Fe3 。往500毫升2.0摩/升的FeBr2溶液中通入a摩氯气,试确定a不同取值范围时的氧化产物及其对应的物质的量,填入下表:
a值的范围
氧化产物及其物质的量
0<a≤ ![]()
![]() <a≤
<a≤ ![]()
a≥ ![]()
【试题答案】
1. B 2. BD 3. B 4. C 5. C 6. C 7. B 8. D 9. C 10. B 11.D 12.B
13. = 1 * GB3 ①PbS 4H2O2 = PbSO4 4H2O = 2 * GB3 ② 0.8
14、(1) x= 1 y= 1 。
(2)6FeSO4 2KNO3 4H2SO4 →K2SO4 3Fe2(SO4)3 2NO 4H2O
(3) KNO3 (4)电子转移总数6
15. (1) ①、④
(2) Cr(OH)3 3 H = Cr3 3H2O 、Cr(OH)3 OH- = CrO2- 2H2O
(3) Na2Cr2O7 6KI 14HCl = 2 CrCl3 2NaCl 6KCl 3I2 7 H2O
16.
a值的范围
氧化产物及其物质的量
0<a≤ ![]()
FeBr3= ![]() 摩,FeCl3=
摩,FeCl3= ![]() 摩(或Fe3 =2a摩
摩(或Fe3 =2a摩
![]() <a≤
<a≤ ![]()
FeBr3= ![]() 摩,Br2=
摩,Br2= ![]() 摩,FeCl3=
摩,FeCl3= ![]() 摩
摩
(或 Fe3 =1摩, Br2= ![]() 摩)
摩)
a≥ ![]()
答:FeCl3=1摩, Br2=1摩
〖提示〗:当 ![]() <a≤
<a≤ ![]() 时,可采用直接配平法:
时,可采用直接配平法:
FeBr2 aCl2 = ![]() FeBr3
FeBr3 ![]() Br2
Br2 ![]() FeCl3
FeCl3
