| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确选项只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分) 11. 在密闭容器中,一定条件下进行如下反应:NO(g) CO(g) A. 加催化剂同时升高温度 B. 加催化剂同时增大压强 C. 升高温度同时充入N2 D. 降低温度同时增大压强 12. 下列反应离子方程式正确的是 A.溴化亚铁溶液中通入过量氯气: Fe2 2Br-— 2Cl2= Fe3 Br2 4Cl— B.氯气通入冷的氢氧化钠溶液中: 2Cl2 2OH— = 3Cl— ClO— H2O
Ca2 OH— HCO3— =CaCO3↓ H2O D.氨水中通入过量二氧化硫: 2NH3·H2O SO2 = 2NH4 SO32— 2H2O 13.下列有关实验问题叙述正确的是 A.测定中和热时,用环形玻璃搅拌棒搅拌溶液使测得的温度更准确 B.利用烧杯、玻璃棒、量筒、容量瓶就可以配制2mol/L的硫酸溶液 C.用pH计测得某次雨水的pH为3.7 D.用标准浓度HCl滴定未知浓度NaOH溶液,中和滴定曲线如上图 14、下列各组离子在溶液中可以大量共存,且加入过量氨水也不产生沉淀的是 A、K+ Ba2+ NO3- SO42- B、H+ NH4+ Al3+ SO42- C、Na+ AlO2- Cl- OH- D、H+ Cl- CH3COO- NO3- 15、现有下列短周期元素性质的数据:
| 元素编号 元素性质
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
| 原子半径
| 1.02
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
| 0.82
| 最高化合价 最低化合价
| 6
| 2
| 1
| 5
| 7
| 1
| 5
| 3
|
| -2
|
|
| -3
| -1
|
| -3
| |
下列说法正确的是:
A.⑦号元素的氢化物溶于水显碱性
B.②号的氧化物是离子化合物
C.①号元素的氢化物的水溶液在空气中存放不易变质
D.④号和⑤号元素最高价氧化物对应的水化物都是强酸
16. 常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是
A. pH>7,且c(OH-)>c(Na )>c(H )>c(CH3COO-)
B. pH>7,且c(Na ) c(H )=c(OH-) c(CH3COO-)
C. pH<7,且c(CH3COO-)>c(H )>c(Na )>c(OH-)
D. pH=7,且c(CH3COO-)>c(Na )>c(H )=c(OH-)
17. 对可逆反应2SO2(g) O2(g) ![]() 2SO3(g),下列判定正确的是
2SO3(g),下列判定正确的是
A. 若单位时间内生成x molSO3的同时,消耗x mol SO2,则反应达到平衡状态
B. 达到化学平衡时,2 ![]() 正(O2)=
正(O2)= ![]() 逆(SO3)
逆(SO3)
C. 平衡时,SO2的浓度必定等于O2浓度的2倍
D. 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
18.下述实验不能达到预期目的的是
编号
实验内容
实验目的
将SO2通入溴水中
证实SO2具有漂白性
B
将Cl2通入NaBr溶液中
比较氯与溴的氧化性强弱
C
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温
研究温度对化学平衡的影响
20℃和50℃分别向两试管中加入同体积同浓度的H2O2溶液,再向其中1支加入少量MnO2
研究催化剂对H2O2分解速率的影响
19. 单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:
① FeTiO3 2H2SO4=TiOSO4 FeSO4 2H2O
② TiOSO4 2H2O=H2TiO3↓ H2SO4
③ H2TiO3 ![]() TiO2 H2O
TiO2 H2O
④ TiO2 2C 2Cl2 ![]() TiCl4 2CO
TiCl4 2CO
⑤ TiCl4 2Mg=2MgCl2 Ti
下列叙述不正确的是
A. 反应①不是氧化还原反应
B. 反应②是水解反应
C. 反应④中TiO2是氧化剂
D. 反应⑤表现了金属镁还原性比金属钛强
20.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A 可用铁作阳极材料
B 电解过程中阳极四周溶液的pH升高
C 阳极反应方程式为:2Cl--2e-=Cl2
D 1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
第二部分 非选择题 共80分
三.(本题包括3小题,共30分)
21(8分)某化学爱好小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液 干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、_____________等玻璃仪器。
(2)步骤1过滤的目的是_____________________________
(3)步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是
(4)步骤2中溶液的pH控制较难操作,可改用___________________
(5)将步骤4补充完整
22.(11分)某化学研究性小组要通过实验来证实一种液体(分子式C2H6O)分子的结构。
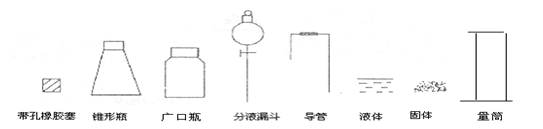 (1)下列简图,画出证实分子结构的实验装置(含试剂)示意图。
(1)下列简图,画出证实分子结构的实验装置(含试剂)示意图。
(2) 实验过程中,使用分液漏斗滴加液体的操作是______________。
(3)实验时测得加入的C2H6O为0.46g,则量筒中最后收集到的水为 mL(假设为标准状况)时,C2H6O的结构简式是C2H5OH。
理由是
(4)若加入的液体是乙醇,测出的H2体积偏小的可能原因是 当乙醇中混有水时,测出的H2体积偏 (填大、小)。
(5)若C2H6O的红外光谱图如下:
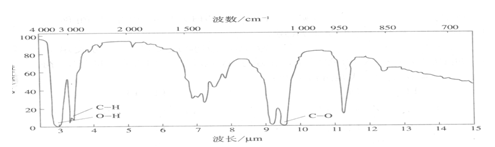
则它的结构简式是
23.(10分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。
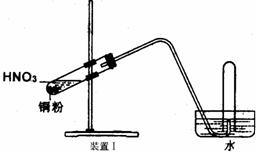
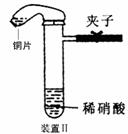
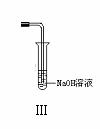
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为
乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是_______________________________________。于是他设计装置Ⅱ。
(2)检验装置Ⅱ的气密性的具体操作和依据是
(3)化学研究小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但假如按装置Ⅱ进行实验,反应速率较慢,为了解决这个问题,在不加热的条件下,可采取的措施是
(4)按装置Ⅱ进行实验,试管中的气体是淡棕红色,而不是无色。
该采取的措施是:__________________(填具体操作。不能增加装置)。
(5)将装置Ⅱ与Ⅲ连接可避免污染空气,实验结束清洗装置Ⅱ前,应先采取的措施是:__________________
四.(本题包括3小题,共30分)
|
24.(10分) 我国化学家侯德榜,改革国外的纯碱生产工业生产工艺,可简要表示如下:
(1)为了有效除去粗盐中含有的少量Ca2 、Mg2 、SO42-等杂质,加入试剂的合理顺序为
(2)化工厂提供的X是 ,目的是 生产过程中,需要控制沉淀池温度在30℃~35℃,原因是
(3)煅烧炉发生反应的化学方程式是
(4)该工厂的铁设备易被腐蚀,其正极的电极反应式是
(5)母液可回收利用物质是
25.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气催化反应生成甲醇:
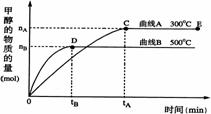 CO(g)+2H2(g)
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)500℃从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其它条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度增大 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时C(CH3OH) /C(CO)增大
(4)一定条件下,向上述容器中通入3molCO(g)和5molH2(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的 ![]() 。若相同条件下,向上述容器中分别通入a molCO(g)、b molH2(g)、c mol CH3OH (g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molCO(g)、b molH2(g)、c mol CH3OH (g),欲使达到新平衡时容器内气体压强仍为P(始)的 ![]() 。①a、b、c必须满足的关系是 ,
。①a、b、c必须满足的关系是 ,
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则b的取值范围是
26.(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
|
100℃ |
![]()
|
750℃ |
![]() (2)根据“绿色化学”的思想,为了制备H2,设计了下列反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,设计了下列反应步骤:
|
500℃ |
![]()
|
250℃ |
![]() ①CaBr2 H2O CaO 2HBr ②2HBr Hg HgBr2 H2
①CaBr2 H2O CaO 2HBr ②2HBr Hg HgBr2 H2
③HgBr2 CaO HgO CaBr2 ④2HgO 2Hg O2↑
你认为该方法的主要缺点是
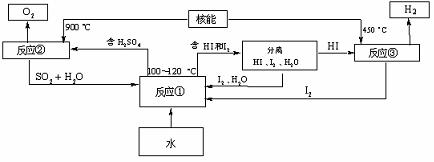
(3)利用核能把水分解制氢气,是目前正在研究的课题。上图是其中的一种流程,其中用了过量的碘,用此法制取氢气最大的优点是:
写出反应①的化学方程式:
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:
|
CH2 |
|
—CH |
|
O |
|
—C—CH |
|
O |
|
= CH |
|
— |
|
n |
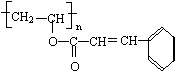 五.(本题包括1小题,共10分)
五.(本题包括1小题,共10分)
27.(10分)感光性高分子又称为“光敏性
高分子”,是一种在彩电荧光屏及大规模集成
电路制造中应用较广的新型高分子材料。其结构简式如上:
(1)在一定条件下,该高聚物可发生的反应有 (填代号)
① 加成反应 ② 氧化反应③ 消去反应④ 酯化反应 ⑤ 卤代反应
(2)该高聚物在催化剂的作用下,水解后的产物中有一种相对分子质量较小的R,其分子式为 。
|
—C—O— |
|
O |
![]() (3)写出R在一定条件下与乙醇反应的化学方程式:
(3)写出R在一定条件下与乙醇反应的化学方程式:
|
C |
|
= C |
![]() (4)R的同分异构体有多种,其中含有苯环、 和
(4)R的同分异构体有多种,其中含有苯环、 和
且苯环上有两个对位取代基的结构简式是
六.(本题包括1小题,共10分)
28.(10分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为_____________________________。
(2)一个A的分子中应有________个氧原子,作出此判定的理由是:
A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:__________________(任写一种)。
1
2
3
4
5
6
7
8
9
10
D
A
C
B
D
D
D
B
B
C
11
12
13
14
15
16
17
18
19
20
B
C
AC
C
AB
AD
B
AD
C
CD
21. (1)烧杯 漏斗 (2分)
(2)除去铁等不溶于碱的杂质(1分)
(3)取上层清液,逐滴加入稀硫酸,若变浑浊,则说明沉淀不完全,基不变浑浊,则说明沉淀完全(2分)
(4)通入足量的CO2气体(2分)
(5) 蒸发浓缩、冷却、结晶、过滤、(2分)
22(1)试剂1分(写C2H5OH得0分)装置2分 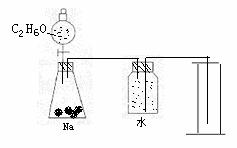
(2)打开分液漏斗上口的玻塞,旋开分液漏斗的旋塞缓慢滴加(2分)
(3)112(1分);与足量金属钠反应的C2H6O的物质的量和产生H2的物质的量之比为2:1,说明C2H6O分子中有一个H原子与其它5个H原子不同(2分)
(4)部分乙醇未与钠反应就挥发溶解在广口瓶的水中:大(各1分)
(5)C2H5OH(1分)
23. (1) 3Cu 8H+ 2NO3―=3Cu2+ 2NO↑ 4H2O(2分)
因为NO2与水反应也可产生NO:3NO2 H2O=2HNO3 NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应。(2分)
(2)夹紧止水夹,微热试管,若气球鼓起说明气密性良好(2分)
(3)将铜片改为Cu粉(1分)
(4)措施:将铜片和少量的碳酸钠固体放入小气球中,排出气球中的空气并用细绳系好后套在试管上,然后打开夹子,将气球内的碳酸钠固体倒入试管内,最后关上夹子后解开绳子,将铜片倒入试管内。(或先将少量碳酸盐倒入试管,然后迅速系上装有铜片的小气球)(2分)
(5)先使装置Ⅲ中的NaOH溶液倒吸至装置Ⅱ中(1分)
24.(1)BaCl2、Na2CO3、NaOH(2分)
(2)NH3(1分)、提高溶液的pH使CO32—浓度增大(1分)、温度太低速率太慢、温度太高NH4HCO3会分解(1分)
(3)2NaHCO3 ![]() Na2CO3 H2O CO2↑(2分)
Na2CO3 H2O CO2↑(2分)
(4)2H2O O2 4e—=4OH—(2分)
(5)NH4Cl(1分)
25.(1)K=c(CH3OH)/c(CO)·c2(H2) (1分), 减小(1分)
(2)2nB/3tBmol·(L·min)-1(2分)
(3)a、b c d(全对得2分,少一个扣1分,扣完为止)
(4)a c=3(1分)、b 2c=5(1分)、2<b≤5(2分)
26.(1)BC (3分,若只选一个对的得1分,全对得3分)
(2)循环过程需要很高的能量,且使用重金属汞会产生污染 (2分)
(3)SO2和I2可循环使用,无污染。 (1分) SO2 I2 2H2O ![]() 2HI H2SO4 (2分)
2HI H2SO4 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。
[或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。(2分)]
27.(1)①、②、⑤ (2分)写对2个给1分,写对3个给2分,写错1个扣1分,但不出现负分,(2)C9H8O2 (2分)
|
—CH |
|
= CH |
|
—C—OH |
|
O |
|
—CH |
|
= CH |
|
H2O |
|
一定条件 |
|
—C—OC2H5 |
|
O |
|
C2H5OH |
![]() (3)
(3)
(2分)化学式错不给分,漏条件扣1分。
|
—CH |
|
= CH2 |
|
—C—H |
|
O |
|
—O |
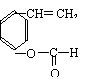 |
|
—C—OH |
|
O |
|
—CH |
|
= CH2 |
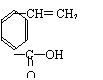 (4)
(4)
(2分) 、 (2分)
28.(1)28(2分)
(2)3(2分)、依题意A分子中至少有一个羧基和一个羟基,而当氧原子数目为4时B的分子量大于200,因此应有3个氧原子(2分)、C8H8O3(2分)
(3) 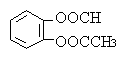 (2分)
(2分)
| |