|
高考化学复习备考试题
化 学 试 卷(十六)
YCY
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,S—32,C1—35.5,
K—39,Ca—40,Fe—56,Cu—64,Zn—65,Ag—108
第Ⅰ卷
(选择题,请将符合题意的选项填有答题卷的空格里,每题只有一个正确选项,每题6分,共48分)
1.下列关于胶体的叙述不正确的是 ( )
A.分散质粒子在1nm—100nm之间的分散系称为胶体,用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
B.光线透过胶体时,胶体发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体
C.布朗运动是胶体的性质之一,布朗运动的胶体稳定的次要原因
D.胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子,故在电场作用下会产生电泳现象,电泳现象可证实胶体属于电解质溶液
2.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,因为炉气中SO2会与杂质反应
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
3.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.在c(H )/c(OH-)=1×10-12的溶液中:I-、CI-、HCO3-、Na
B.在能使pH试纸变红色的溶液中:Na 、S2-、NO3-、C122-
C.在加入铝粉能产生H2的溶液中:NH4 、Fe2 、SO42-、C1-
D.由水电离出的c(H )=1×10-12mol·L-1的溶液中:K 、C1-、NO3-、Na
  4.下列离子方程式正确的是 ( ) 4.下列离子方程式正确的是 ( )  A.澄清石灰水中滴加稀硝酸:Ca(OH)2 2H Ca2 2H2O A.澄清石灰水中滴加稀硝酸:Ca(OH)2 2H Ca2 2H2O
B.用Pt电极电解饱和氯化镁溶液:2C1- 2H2O 20H- H2↑ C12↑
 C.向FeBr2溶液中通入过量氯气:2Fe2 C12 2Fe3 2C1- C.向FeBr2溶液中通入过量氯气:2Fe2 C12 2Fe3 2C1-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
 Ca2 2HCO3- CaCO3↓ CO32- 2H2O Ca2 2HCO3- CaCO3↓ CO32- 2H2O
5.用惰性电极电解某溶液时,发现两极只有H2和O2生成。则电解一段时间后,下列有关该溶液(与电解前同湿度)的说法中,正确的有 ( )
①该溶液的PH可能增大; ②该溶液的PH可能减小;
③该溶液的PH可能不变; ④该溶液的浓度可能增大;
⑤该溶液的浓度可能不变; ⑥该溶液的浓度可能减小;
A.三种 B.四种 C.五种 D.六种
 6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn 2K2FeO4 8H2O 3Zn(OH)2 2Fe(OH)3 4KOH,下列叙述不正确的是 ( ) 6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn 2K2FeO4 8H2O 3Zn(OH)2 2Fe(OH)3 4KOH,下列叙述不正确的是 ( )
A.放电时负极反应为: 
B.充电时阳极反应为: 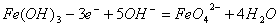
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极四周溶液的碱性增强
5.将3mol A和2.5mol B充入容积为2L的密闭容器中,发生如下反应:
 3A(气) B(气) nC(气) 2D(气),经测定,5min后反应达到平衡状态,生成1mol D, 3A(气) B(气) nC(气) 2D(气),经测定,5min后反应达到平衡状态,生成1mol D, 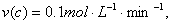 下列结论中正确的是 ( ) 下列结论中正确的是 ( )
①平衡时B的转化率为20% ②平衡时B的浓度为1mol·L-
③经计算,n值为1 ④ 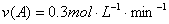
A.①② B.①④ C.②③ D.③④
8.城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,四周有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,YC绘制成简图如图B所示。下列说法不正确的是
( )
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物可能是造成X河污染的污染源
C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理
第Ⅱ卷
9.(12分)物质A是化合物,B、C、D、K都是单质,反应②—⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B ;
C ;
D ;
K ;
G ;
J 。
(2)写出下列反应的离子方程式:
①H E(溶液)→M
。
②I溶于G
。
(3)通常状况下,若1gC气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2molH气体完全分解生成C气体和B气体的热化学方程式为
10.(12分)如图所示,若电解5min时铜电极质量增加2.16g,试回答:
(1)电源电极X名称为 。
(2)PH变化:A ,
B ,
C 。
(3)通电5min时风吹草动共收集224mL气体(标况),溶液体积为200mL,则B中阳极的电极反应式为
。
通电前硫酸铜溶液的物质的量浓度为
。
(4)A中发生反应的化学方程式为
。
若A中KCI溶液的体积也是200mL,电解后溶液的PH=
。
11.(12分)某实验小组欲制取氧化铜并证实氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤、晾干后研细备用。回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验序号),步骤①、③中研磨固体所用仪器的名称是 ;
(2)步骤③中洗涤沉淀的操作是
(二)证实氧化铜能加快氯酸钾的分角并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KC1O3质量 |
其它物质质量 |
待测数据 | |
④ |
1.2g |
无其他物质 |
| |
⑤ |
1.2g |
CuO 0.5g |
| |
⑥ |
1.2g |
MnO2 0.5g |
| | ![]()
![]() (2)①H C1O-=HC1O、NH3 H2O NH3·H2O NH4 OH-(各2分)
(2)①H C1O-=HC1O、NH3 H2O NH3·H2O NH4 OH-(各2分) 2H2O
2H2O