| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3 ) B.氧化性比较: KMnO4>Cl2>Fe3 >Br2>Fe2 C.还原性比较: H2O2>Mn2 >Cl- D.④的离子方程式配平后,H 的化学计量数为16 14.下列物质的保存方法正确的是 ( ) ①少量金属钠保存在冷水中 ②浓硝酸盛放在无色试剂瓶中 ③少量金属钾保存在煤油中 ④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中 ⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡胶塞的细口瓶中 ⑦氢氟酸保存在塑料瓶中 A.②③④⑦ B.③④⑥⑦ C.③④⑦ D.①③④⑦ 15.下列反应的离子方程式正确的是 ( ) ①往硝酸银溶液中滴加少量氨水:Ag 2NH3==[Ag(NH3)2] ②将金属钠加入水中 2Na 2H2O = 2Na 2OH - H2 ↑ ③石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO- Ca2 CO2↑ H2O ④氟气与水反应: F2+H2O=H F -+ HFO ⑤小苏打溶液中加入少量的石灰水:Ca2 2OH-+2HCO3-=CaCO3↓+CO32- 2H2O ⑥次氯酸钙溶液中通入过量二氧化碳:Ca2 2ClO- CO2 H2O =CaCO3↓ 2HClO ⑦钠与硫酸铜溶液反应:Cu2 2Na =2Na Cu ⑧氯气与水反应Cl2 H2O = 2H Cl - ClO- ⑨纯碱溶液中滴加少量盐酸CO32- H = HCO3- A.①②⑤⑨ B.②③⑤⑨ C.④⑤⑥⑦ D.②③⑧⑨ 16.用6.02×1023表示阿伏加德罗常数(NA)的值,下列说法中正确的是 ( )
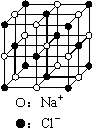 A.在SiO2晶体中,若含有1mol Si原子,则含Si—O A.在SiO2晶体中,若含有1mol Si原子,则含Si—O
键数为2NA B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子 C.23.4 g NaCl晶体中含有6.02×1022个右图所示的结构单元 D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中, 胶粒数等于0.1 NA 三、(本题包括3小题,共22分) 17.(6分) 在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是__________________;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是__________________________。从以上事实可知,ClO-、I2.SO42-的氧化性由弱到强的顺序是___________________。 18.(8分)为防止碘缺乏病,Y通常在食盐中加入KIO3。 (1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是________________________________________,若要确认食盐中还含有K+,方法是______________________________________________________________。 (2)工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是____________________________,电解过程中铁电极四周溶液pH__________(填“变大”、“变小”或“不变”)。 19.(8分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。按要求回答下列问题: (1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因___________________________________________________________________。 (2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?__________,若能,请写出电极反应式,负极__________________,正极_________________。(若不能,后面两空不填) (3)若电池反应为:Cu 2H = Cu2 H2↑,该池属于原电池还是电解池?__________,请写出各电极的电极材料和电解质溶液_________________________________。 四、(本题包括2小题,共16分) 20.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键
| Si—O
| Si—Cl
| H—H
| H—Cl
| Si—Si
| Si—C
| 键能/ KJ·mol—1
| 460
| 360
| 436
| 431
| 176
| 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低Y(填>或<=SiC______ Si; SiCl4 ______ SiO2
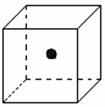 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
![]() SiCl4 (g) 2H2(g) Si(s) 4HCl(g)
SiCl4 (g) 2H2(g) Si(s) 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
|
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式或离子方程式:
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称_________________________________
五、(本题包括2小题,共16分)
22.(8分)某校化学爱好小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3.Cu(NO3)2.AgNO3。(加热及夹持装置未画出)
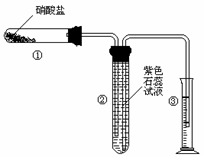
(1)甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程式: 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,英才剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
![]() (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
![]() (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
由: ;
请你设计一个简单的实验证实你的结论是正确的: ;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
23.(8分)为了证实在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
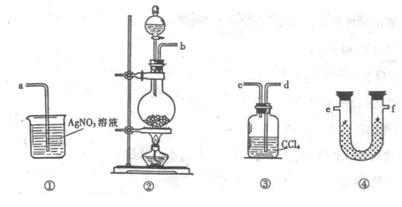
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
|
(2)U形管中所盛试剂的化学式为 。
(3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证实最终通入AgNO3
溶液中的气体只有一种。为了确保实验结论的可靠性,证
明最终通入AgNO3 溶液的气体只有一种,乙同学提出在
某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
六、计算题(6分)
24.为测定某氧化物(化学式为MO)中M是何种金属,做以下实验:称取该氧化物8.0g溶于适量的稀H2SO4中,再配制成250.0mL溶液。取该溶液50mL,用惰性电极进行电解,当刚好电解完时,电极上析出M1.28g.请通过计算回答下列问题:
(1)M是什么金属?
(2)电解过程中,导线上流过的电子个数是多少?
(3)若此电解液在电解后体积为40mL,此溶液的pH为多少?
参考答案
一、单选(共16分)
1
2
3
4
5
6
7
8
C
B
A
C
A
A
C
B
二、单选(共24分)
9
10
11
12
13
14
15
16
D
D
C
B
D
C
B
C
三、(共22分)
17.(6分)离子方程式是_ ClO- 2H 2I- = I2 Cl- H2O _(2分);
离子方程式是_ I2 H2O SO32- = _ SO42- 2H 2I-(2分);
氧化性由弱到强的顺序是_____ SO42- <I2 <ClO-_(2分)。
18.(8分)(1)离子方程式是__ IO3- 5I- 6H _=_3I2 3H2O __(2分);
方法是 取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+(答取上述反应后溶液进行实验不给分) (1分);
(2) 阳极 (填“阳极”或“阴极”),(1分)
石墨电极上的电极反应式是___I-+3H2O-6e-=IO3-+6H+___,
或_I-+6OH--6e-=IO3-+3 H2O_(2分)
pH____变大______(填“变大”、“变小”或“不变”)。
19.(8分)
(1)原因 二者连接在一起时,接头处在潮湿的空气中形成原电池而腐蚀 (2分);
(2)____能______,(1分)
若能,则电极反应式是:负极 ![]() ,(1分)
,(1分)
正极_ ![]() 。(1分)
。(1分)
(3)__电解池__,(1分)
写出各电极材料和电解质溶液_阴极:石墨,电解液:盐酸或硫酸_(2分)。
四、(共16分)
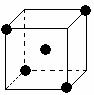 20.(8分)(1)SiC__>__ Si; SiCl4 __<__ SiO2 (填>或<=
20.(8分)(1)SiC__>__ Si; SiCl4 __<__ SiO2 (填>或<=
(2)立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3) 该反应的反应热△H = __ 236___ KJ/mol。
21.(8分)(1)A____ FeS2 ______________ B_______ O2 _____________
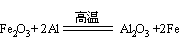
(2)反应③的化学方程式_____________ ;
反应⑤的离子方程式___2Cl- 2H2O = 2OH- Cl2↑ H2↑ ;
(3)写出反应①所使用设备的名称___沸腾炉_ 。
五、(共16分)
22.(8分)(1)NaNO3受热分解的化学方程式: 2NaNO3=2NaNO2 O2 ↑ ;
(2)Cu(NO3)2受热分解的化学方程式: 2Cu(NO3)2 =2CuO 4NO2↑ O2↑ ;
(3) Ⅱ正确;气泡仅部分消失,且剩余氧气等等 ;
(4)硝酸盐受热分解的产物可能与 盐中金属元素的活泼性 有关。
23.(8分)(1)b接e,f接d,c接a。
(2)CuSO 4
(3)吸收Cl2
(4)①③;湿润的KI淀粉试纸(或润湿的有色布条,或品红溶液)
(5)紫色石蕊试液(答案合理给分);紫色石蕊试液变红而不褪色
六、(6分)
24.(1)Cu (2)0.04NA或2.408×1022个 (3)pH = 0
| |