| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
30.(2005年北京理综8)右表为元素周期表前四面期的一部分,下列 有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) [答案]D A.常压下五种元素的单质中Z单质的沸点最高 B.Y、Z的阴离子电子层结构都与R原子的相同 C.W的氢化物沸点比X的氢化物的沸点高 D.Y元素的非金属性比W元素的非金属性强 31.(2004年全国理综Ⅰ8)2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是 [答案]C A.Ds原子的电子层数为7 B.Ds是超铀元素 C.Ds原子的质量数为110 D.Ds为金属元素
影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的 体积分数。下列叙述正确的是 [答案] C A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态 C.X和Y中只有一种是气态,Z为气态 D.上述反应的逆反应的△H>0 33.(2004年理综Ⅳ 13)某温度下在密闭容器中发生如下反应:
混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的 混合气体,达平衡时M的转化率为 [答案] C A.20% B.40% C.60% D.80% 34.(2004年全国理综Ⅱ9)将0.l mol· A.溶液中c(H )和c(OH-)都减小 B.溶液中c(H )增大 C.醋酸电离平衡向左移动 D.溶液的pH增大 35.(2004年广东14)甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H )约为乙酸中c(H )的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 [答案] A A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度 C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度 36.(2004年江苏16)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s) 2MnO2(s) H2O(l) = Zn(OH)2(s) Mn2O3(s) 下列说法错误的是 [答案] C A.电池工作时,锌失去电子 B.电池正极的电极反应式为:2MnO2(s) H2O(1) 2e‾ = Mn2O3 (s) 2OH‾ (aq) C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g 37.(2004年江苏4)下列关于浓硫酸的叙述正确的是 [答案] D A.浓硫酸具有吸水性,因而能使蔗糖炭化 B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 D.浓硫酸在常温下能够使铁、铝等金属钝化 38.(2004年广东13)下列反应完成后没有沉淀的是 [答案] D A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOH B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4 C.AgNO3溶液与Na2CO3溶液加足量稀HCl D.Ca(OH)2溶液与FeCl3溶液加足量稀HNO3 39.(2004全国理综Ⅱ12)下列分子中,所有原子不可能共处在同一平面上的是[答案]C A.C2H2 B.CS2 C.NH3 D.C6H6 40.(2006年理综全国1)下列叙述正确的是( )[答案] D A.同一主族的元素,原子半径越大,其单质的熔点一定越高 B.同一周期的元素,半径越小越轻易失去电子 C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 D.稀有气体元素的原子序数越大,其单质的沸点一定越高 41.(2000年广东综合21)绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)[答案] C A. C. D. 42. (2004年上海化学试题)某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有:[答案] D A. 两个羟基 B. 一个醛基 C. 两个醛基 D. 一个羧基 43.(2005年全国理综Ⅲ 7)下列气体的制备可采用右图装置的是 [答案] B
C.乙醇与浓硫酸反应制乙烯 D.氯化钠与浓硫酸反应制HCl 44.(2004年江苏 9)下列分离或提纯物质的方法错误的是( )[答案] C A.用渗析的方法精制氢氧化铁胶体 B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠 C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡 D.用盐析的方法分离、提纯蛋白质 45.(2005年全国理综Ⅰ13)已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )[答案] A A.2C2H2(g) 5O2(g) B.C2H2(g) C.2C2H2(g) 5O2(g) D.2C2H2(g) 5O2(g) 第二部分. 非选择题 17.(2004年上海卷23)某化学反应的反应物和产物如下:KMnO4 KI H2SO4→MnSO4 I2 KIO3 K2SO4 H2O (1)该反应的氧化剂是 (2)假如该反应方程式中I2和KIO3的系数都是5①KMnO4的系数是 , ②在下面的化学式上标出电子转移的方向和数目KMnO4 KI H2SO4 → (3)假如没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是 。 [答案](1)KMnO4 (2)① 8 ② (3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化 18.(06年高考题)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件: ① 元素周期表中,Z和Y相邻,Z与W也相邻;② Y、Z和W三种元素的原子最外层电子数之和为17。 请填空: (1)Y、Z和W三种元素是否位于同一周期(填"是"或"否"):_______,理由是_________________; (2)Y是________,Z是__________,W是___________________; (3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1。写出该化合物的名称及化学式_______。 [答案](1)否 , 若三者处于同一周期,则最外层电子之和不可能为17 (2) N O S (3)硫酸铵 (NH4)2SO4 19.(2004年全国理综Ⅳ26)下图表示某种盐的制备步骤:
已知:水合盐B含有45.3%的水;无水盐C焙烧分解,放出两种无色刺激性气体E和F,并生成红棕色固体D。请写出物质的化学式或名称: A ,B ,C ,D ,E ,F 。 [答案]A.Fe B.FeSO4·7H2O C.FeSO4 D.Fe2O3 E.SO2 F.SO3(或 E.SO3 F.SO2) 20.(2004年全国理综Ⅱ26)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验: ①取适量A进行铝热反应,产物中有单质B生成; ②另取20 g A全部溶于0.15 L 6.0 mol·L—1盐酸中,得溶液C; ③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体同时生成溶液D,还残留有固体物质B; ④用KSCN溶液检验时,溶液D不变色。 请填空: (1)①中引发铝热反应的实验操作是_____________________,产物中的单质B是_______。 (2)②中所发生的各反应的化学方程式是_____________________________________。 (3)③中所发生的各反应的离子方程式是_____________________________________。 (4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2 )为______, c(Fe2 )为_______。 [答案](1)加少量KClO3,插上Mg条并将其点燃 Fe (2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O (3)Fe+2H =Fe2 +H2↑ Fe+2Fe3 =3Fe2 (4)c(Mg2 )= 0.67mol· 21.(2007年高考海南化学卷17题) 下表是稀硫酸与某金属反应的实验数据:
| 实验序号
| 金属 质量/g
| 金属状态
| C(H2SO4) /mol·L-1
| V(H2SO4) /mL
| 溶液温度/℃
| 金属消失的时间/s
| 反应前
| 反应后
| 1
| 0.10
| 丝
| 0.5
| 50
| 20
| 34
| 500
| 2
| 0.10
| 粉末
| 0.5
| 50
| 20
| 35
| 50
| 3
| 0.10
| 丝
| 0.7
| 50
| 20
| 36
| 250
| 4
| 0.10
| 丝
| 0.8
| 50
| 20
| 35
| 200
| 5
| 0.10
| 粉末
| 0.8
| 50
| 20
| 36
| 25
| 6
| 0.10
| 丝
| 1.0
| 50
| 20
| 35
| 125
| 7
| 0.10
| 丝
| 1.0
| 50
| 35
| 50
| 50
| 8
| 0.10
| 丝
| 1.1
| 50
| 20
| 34
| 100
| 9
| 0.10
| 丝
| 1.1
| 50
| 20
| 44
| 40 | ||||||||||||||||||||||||||||||||||||
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
。
[答案] (1)固体反应物的表面积 表面积越大 1和2 (2)3和4
(3)开始反应温度 6和7 (4)一定量的金属跟足量的硫酸反应放出的热量相同。
22. (2005年北京理综卷27)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。 已知:
 ①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,
C(I)、C(II)为多孔石墨电极。接通S1后,C(I)四周溶液变红,
两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),
断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
[答案](1)Na2O (2)2Na2O2 2H2O 4NaOH O2↑ (3)负极 Cl2 2e- 2Cl-
 (4)Cu H2O2 2H
(4)Cu H2O2 2H Cu2 2H2O
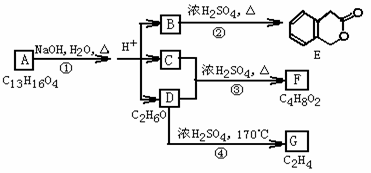
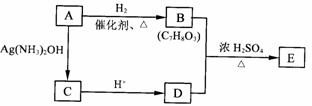
23.(2007年全国理综卷Ⅰ29题)下图中
A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
(1)D的化学名称是 。
(2)反应③的化学方程式是 。
(有机物须用结构简式表示)
(3)B的分子式是 。A的结构简式是 。
反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体的数目有 个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途 。
 [答案]
[答案]
![]() 24.(2004年全国卷Ⅲ 27)芳香化合物A、B互为同分异构体,B的结构简式是:
24.(2004年全国卷Ⅲ 27)芳香化合物A、B互为同分异构体,B的结构简式是:
 |
过程、产物性质及相互关系如图所示。
(1)写出E的结构简式 。
(2)A有2种可能的结构,写出相应的结构简式 。
(3)F和小粒金属钠反应的化学方程式是 ,
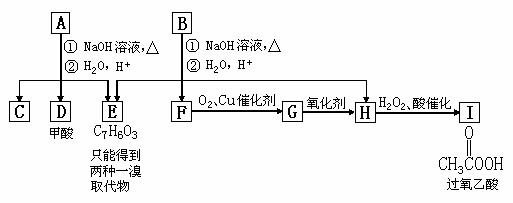 实验现象是 ,反应类型是 。
实验现象是 ,反应类型是 。
(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式:
,实验现象是 ,反应类型是 。
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式
,实验现象是 ,反应类型是 。
(6)在B、C、D、F、G、I化合物中,互为同系物的是 。
[答案]
25.(2005年全国卷I 29)苏丹红一号(sudan Ⅰ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2-萘酚为主要原料制备的,它们的结构简式如下所示:
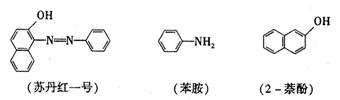
(1)苏丹红一号的化学式(分子式)为
(2)在下面化合物(A)~(D)中,与2-萘酚互为同分异构体的有(填字母代号)
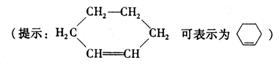
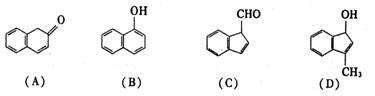
(3)上述化合物(C)含有的官能团是
(4)在适当的条件下,2-萘酚经反应可得到芳香化合物E(C8H6O4),1 mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴取代物,两种一溴取代物的结构简式分别是 ,E与碳酸氢钠反应的化学方程式是 。
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是 反应类型是 酯化反应。
[答案](1)C16H12N2O(2)A B C(3)碳碳双键 醛基
|
Br |
|
-COOH |
|
-COOH |
|
-COOH |
|
-COOH |
|
Br |
 | |||
 | |||
(4)
|
-COOH |
|
-COOH |
|
2NaHCO3 = |
|
2H2O 2CO2↑ |
|
-COONa |
|
-COONa |
 |
(5)
|
-COOH |
|
-COOH |
|
2C2H5OH |
|
2H2O |
|
-COOC2H5 |
|
-COOC2H5 |
|
△ |
|
浓H2SO4 |
 |
(6)
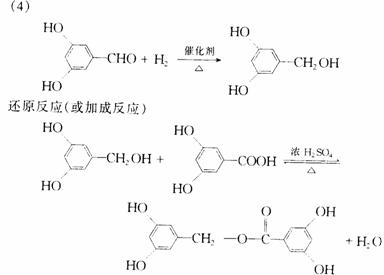
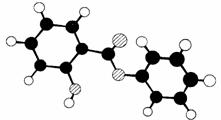 26.(06年全国理综Ⅰ)萨罗(Salol)是一种消毒剂,它的分子式
26.(06年全国理综Ⅰ)萨罗(Salol)是一种消毒剂,它的分子式
为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化
学键,如单键、双键等):
(1)根据右图模型写出萨罗的结构简式:_______________;
(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸
(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的
酸性依次增强(用化学方程式表示)。
(3)同时符合下列四个要求的水杨酸的同分异构体共有______________种。
① 含有苯环 ② 能发生银镜反应,不能发生水解反应;
③ 在稀NaOH溶液中,1mol该同分异构体能与2mol NaOH发生反应;④ 只能生成两种一氯代物。
 (4)从(3)确定的同分异构体中任选一种,
(4)从(3)确定的同分异构体中任选一种,
指定为下列框图中的A。
写出下列两个反应的化学方程式(有机物用
结构简式表示),并指出相应的反应类型:
① A → B: _______ __________;
反应类型:_____________ 。
② B D →E:__________________________;
反应类型:_____________。
(5) 现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol。该混合物完全燃烧消耗a L O2,并生成b g H2O和c L CO2(气体体积均为标准状况下的体积)。
① 分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示)。
② 设混合物中水杨酸的物质的量为x mol,列出x的计算式。
 【答案】
【答案】

(3) 2

27.(2005年全国理综 Ⅱ29)某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
⑴该化合物分子中含有几个氧原子,为什么?
⑵该化合物的相对分子质量(分子量)是 。
⑶该化合物的化学式(分子式)是 。
⑷该化合物分子中最多含 个 官能团。
[答案]⑴答案要点:4个氧原子。因为:110<A的相对分子质量<150
氧在分子中的质量分数为1-52.24%=47.76%所以 52.5<分子中氧原子的相对原子质量之和<71.6
又因为只有4个氧原子的相对原子质量之和(64)符合上述不等式,所以化合物A中含4个氧原子。(5分) ⑵134(4分) ⑶C5H10O4(4分) ⑷1(3分)
28.(2004年全国理综Ⅰ28)有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba (OH )2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。
试回答下面问题。
⑴A的化学式是 ,G的化学式是 。
判定理由是 。
⑵写出其余几种物质的化学式。
A
B
C
D
E
F
G
A
-
-
-
-
-
-
↓
B
-
-
-
-
↓
↓
↓
C
-
-
―
↓
↓
↓
D
-
-
↓
-
↓
↓
↓
E
-
↓
-
↓
-
↓
-
F
-
↓
↓
↓
↓
-
↓
G
↓
↓
↓
↓
-
↓
-
B: ,C: ,D: ,
E: ,F: 。
[答案]
⑴ KCl;AgNO3;混合时只生成一种沉淀的是KCl,
生成的是AgCl,所以A是KCl,G是AgNO3。
⑵ B:Na2SO4 C:MgCl2 D:Na2CO3 E:Ca(NO3)2 F:Ba(OH)2
9.(2004年广东卷21)A、B、C、D是四种可溶的化合物,分别由
阳离子K 、Ba2 、Al3 、Fe3 和阴离子OHˉ、 ![]() 、
、 ![]() 、
、 ![]()
两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完
全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。
写出它们的化学式:A: B: C: D:
[答案] Ba(OH)2;Al2(SO4)3;K2CO3;Fe(NO3)3
30.(2003年广东卷19)(1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝聚成像冰一样的晶体。请简单说明在实验中若碰到这种情况时,你将如何从试剂瓶中取出无水乙酸。
答:
(2)要配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是 (填代号)。
A. 称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B. 称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C. 称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
 D. 用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
D. 用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
[答案](1)略 (2)A、D
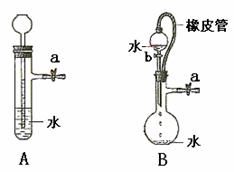
31.(204年全国理综28)根据下图及描述,回答下列问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入
一定量的水,静置后如图所示。试判定:A装置是否漏气?
(填“漏气”、“不漏气”或“无法确定”) ,
判定理由:
。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判定:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) ,
判定理由:
。
[答案] (1)不漏气;由于不漏气,加水后试管内气体体积减小,导致压强增大,长颈漏斗内的水面高出试管内的水面。
 (2)无法确定;由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶。
(2)无法确定;由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶。
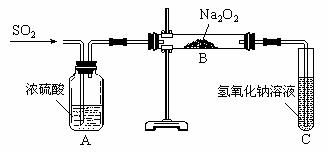
32.(2004年江苏卷 20)有两个实验小组的同学为
探究过氧化钠与二氧化硫的反应,都用如下图所
示的装置进行实验。通入SO2气体,将带余烬的
木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了
Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证实Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
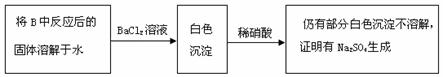
上述方案是否合理? 。请简要说明两点理由:
① ;② 。
[答案] (1)2Na2O2 2SO2=2Na2SO3 O2 (2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。
(3)不合理 ; 稀硝酸能将亚硫酸钡氧化为硫酸钡;
假如反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
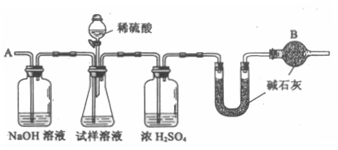 33.(2005年全国理综Ⅰ29)已知某纯碱试样中含
33.(2005年全国理综Ⅰ29)已知某纯碱试样中含
有NaCl杂质,为测定试样中纯碱的质量分数,
可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放人锥形瓶中,加适量蒸馏水
溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量得到b g
④从分液漏斗滴人6mol·L-1 的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓人一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,假如天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)假如将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是 ,(5)步骤⑦的目的是 。
(6)该试样中纯碱的质量分数的计算式为 。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
[答案](1)样品重,砝码轻 (2)防止空气中的CO2和水气进入U型管中
(3)偏高 (4)把反应产生的CO2全部导入U型管中
(5)判定反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收
(6) ![]() (7)答案略。
(7)答案略。
[以下答案仅供(7)参考:① 酸碱中和滴定法② 重量法 a.Ba2 法、b.Ca2 法、c.Ag 法 、d.HCl法
说明:① 滴定法,简述必须指明正确的指示剂或标准溶液
② 重量法,简述中必须指明所加入的试剂及结果处理方法。]
34.(03年江苏卷26)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判定的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判定的理由是 。
[答案](1)(1-a) (2)3a (3)2 3-3a 丁 若3a>1,B的物质的量小于2mol;
若 ![]() ,B的物质的量等于2mol; 若3a<1,B的物质的量大于2mol
,B的物质的量等于2mol; 若3a<1,B的物质的量大于2mol
(4) ![]()
(5)乙; 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
35.(2000年广东卷29)下图是100 mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
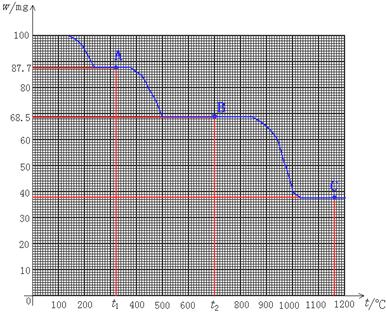
(1) 温度分别为t1和t2时,固体产物的化学式A是_____________,B是:_____________。
(2)由CaC2O4·H2O得到A的化学方程式为_________________________。
(3)由A得到B的化学方程式为___________________________________。
(4)由图计算产物C的分子量,并推断C的合理的化学式。
[答案](1)CaC2O4 ; CaCO3 (2)CaC2O4·H2O ![]() CaC2O4十H2O
CaC2O4十H2O
(3) CaC2O4 ![]() CaCO3 +CO (4)由图读得分解产物C的质量约为38 mg
CaCO3 +CO (4)由图读得分解产物C的质量约为38 mg
C的相对分子质量= ![]() =56 (或C的相对分子质量=
=56 (或C的相对分子质量= ![]() =56)
=56)
由此推断C的化学式是CaO (1分)
36.(2004年北京理综29)有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12 L气体(标准状况),则样品①中氧化铜的质量为 g.
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 。样品②中氧化铜质量为 g(以含a、b的代数式表示)
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 。
[答案](1) 6.0 ; (2) C ![]() ; (3)
; (3) ![]()
| |