| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(1)通过分析x值变化规律,确定N、Mg的x值范围: _______________<x(Mg)<____________,______________<x(N)<___________________。 (2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。 (3)某有机化合物结构式为 (4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。 (5)猜测元素周期表中,x值最小的元素位置:______________(放射性元素除外)。 解析:题中给出第二、第三周期元素的x值(其中缺少了氮、镁两种元素的x值),x值与这种原子在分子中吸收电子的能力有关。 可根据元素性质的周期性变化来推测镁和氮的x值。从表中数值可看出,同周期中元素的x值随原子半径的减少而增大,x值的变化体现了元素性质的周期变化。 用x值大小可判定共价键中共用电子对偏向哪一方。对于S—N,由于N的x值大于S的x值,所以其中共用电子对偏向N原子。 表中查不到溴的x值,可根据元素周期律来推测,氯与溴同主族,氯的x值必定比溴的x值大,而:x(Cl)-x(Al)=3.16-1.61=1.45<1.7,而溴与铝的x值这差必定小于1.45,所以溴化铝肯定属于共价化物。 x值越小,元素的金属越强,x值最小的元素应位于第六周期的IA主族。 答案:(1)0.93<x(Mg)<1.61,2.55<x(N)<3.44。(2)同周期(同主族)中,x值大,其原子半径越小;周期性。(3)氮原子。(4)共价键。(5)第六周期IA主族。 【例4】不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_______________。各主族中E值的这种变化特点体现了元素性质的_______________变化规律。 (3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:_______<E<_______ (4)10号元素E值较大的原因是________。 解析:本题以元素的气态原子失去最外层一个电子所需要的能量为依据,考查了对元素周期律的把握和理解,同时考查了对元素性质递变规律的熟悉。 答案:(1)随着原子序数增大.E值变小 周期性 (2)①③(3)419 738[或填E(钾) E(镁)](4)10号元素是氖.该元素原子的最外层电子排布已达到8个电子稳定结构. 本章单元过关测试 一、选择题(每小题只有1个或两个正确答案,各3分,共54分) 1.物质的量相同的Mg2+、F-、H2O三种微粒,一定含有相同的 A.电子数 B.质子数 C.中子数 D.质量数 2.医学研究证实,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是 A.53153I是碘的一种同素异形体 B.53135I是一种新发现的元素 C.53135I核内的中子数与核外电子数之差为29 D.53135I位于元素周期表中第4周期ⅦA族 3.某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是 A.M层 B.K层 C.L层 D.P层 4.下列元素中,最高正化合价数值最大的是 A.C B.S C.F D.Ne 5.下列化合物中,阳离子半径与阴离子半径比值最小的是 A.NaF B.NaCl C.MgI2 D.KBr 6.下列各组中的分子,全部是以极性键形成的非极性分子的是 A.H2、N2、Cl2 B.CH4、NH3、H2O C.CO2、CS2、CCl4D.HCl、NO、Br2 7.下列说法正确的是 A.难失电子的原子,得电子的能力一定强 B.易得电子的原子,失电子的能力一定弱 C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大 D.任何原子的原子核都是由质子和中子构成的 8.已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是 A.n=m 16 B.n=m 6 C.n=m 30 D.n=m 10 9.A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为 A.n 8 B.n 18 C.n 32 D.n 20 10.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是 A.b、a、e、d、c B.e、d、a、b、c C.a、b、d、c、e D.c、d、e、a、b 11.下列说法中,不正确的是 A.双原子分子中的共价键,一定是非极性键 B.非极性键也可能存在于离子化合物中 C.分子间作用力,又叫范德华力,它比化学键要弱得多 D.共价化合物在液态时不能导电 12.元素周期表的第7周期称为不定全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是 A.该周期的元素都是放射性元素 B.该周期的元素,原子序数最大为118 C.该周期的ⅦA族元素是金属元素 D.该周期的ⅢA族的元素的氢氧化物具有两性 13.硼有两种天然同位素510B和511B,硼元素的相对原子质量为10.80,则对硼元素中510B的质量百分含量的判定正确的是 A.20% B.大于20% C.大于20% D.80% 14.R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定不正确的是 A.原子半径:R<Q B.R和Q可形成离子化合物 C.R和Q可形成非极性分子RO2 D.R和Q可形成共价化合物RO3 15.A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判定是 A.原子序数:A<B B.A和B可能在同一主族 C.A可能在第2周期ⅣA族 D.A肯定是金属元素 16.下列叙述中,不正确的是 A.不同的原子之间只能构成共价化合物 B.单质中不一定存在非极性键 C.非金属原子之间只能构成共价化合物 D.Cl2的沸点比F2高,这与分子间作用力的大小有关 17.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是 A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W C.原子最外层电子数:Y>X>Z>W D.金属性:X>Y,还原性:W2->Z- 18.同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是 A.它是一种共价化合物 B.它既含离子键又含共价键 C.它不可能与NaOH溶液反应 D.它受热时,可能会分解产生有色气体 二、填空题(39分) 19.(5分)有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化: (1)A B 由此可知它们的化学式分别为: A ,B , C ,D ,E 。 20、(6分)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物时,其电子式为 ,若XY2为共价化合物时,其形成过程的电子式为 。 21.(8分)短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
| A
|
| C
|
| B
| |
(1)A的氢化物分子式为 ,分子构型为 ,属于 分子;
(2)B的元素符号为 ,原子结构示意图为 ,在周期表中位于第 周期族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
22.(10分)据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
(2)制备含O2-、O22-甚至O2 的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
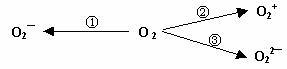
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2 的化合物,请写出一种含有O2-的氧化物的化学式:__________________。
23.(10分)A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如下关系:若A为单质有色气体,请判定:(填化学式)
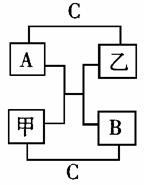
A是 ,B是 , C是 ,甲是 ,乙是 。
三、计算题(7分)
24.某核素ZAX的氯化物XCl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数。
(2)若X的核内中子数为20,求37gXCl2中所含质子的物质的量是多少?
参考答案
一、一、选择题(每小题只有1个或两个正确答案,各3分,共54分)
1.A 2.C 3.A 4.B 5.C 6.C 7.D 8.D 9.D 10.A 11.A 12.D 13.B 14.A D 15.AC 16.AC 17.AC 18.BD
二、填空题(39分)
19. (5分)OH-,NH4+,H2O,NH3,H3O+
20.(6分)[∶ ![]()
![]() ]-Ca2 [∶
]-Ca2 [∶ ![]()
![]() ]-,
]-, ![]() ∶
∶ ![]() C
C ![]() ∶
∶ ![]()
![]()
![]() ∶
∶ ![]() C
C ![]() ∶
∶ ![]()
21.(8分)(1)NH3,三角锥形,极性 (2)S, 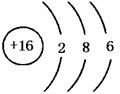 3,ⅥA (3)F2,氢氟酸。
3,ⅥA (3)F2,氢氟酸。
22.(10分)(1)C、D (2)②;①③ (3) ![]() ; (4)KO2(其它合理的化学式也同样给分)。
; (4)KO2(其它合理的化学式也同样给分)。
23、(10分)F2、O2、H2、H2O、HF
三、计算题(7分)24.(7分)(1)40 (2)18mol
| |