|
考点解析复习专题辅导10.氯气
1.复习重点
1.Cl2的化学性质以及Cl2的实验室制法和主要用途。
2.重点是氯水性质的多重性,难点是Cl2的实验室制法。
2.难点聚焦
1.氯元素的知识网络
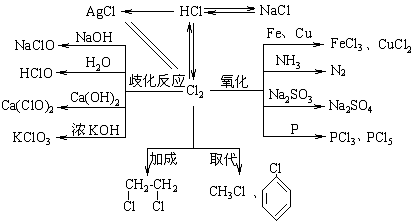
2.次氯酸、漂白粉的性质
HClO分子的结构式为H-O-Cl(氧处于中心),所以电子式为 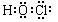 。次氯酸、次氯酸钙等有多方面的性质,经常用到以下几方面性质: 。次氯酸、次氯酸钙等有多方面的性质,经常用到以下几方面性质:
(1)HClO是一种弱酸,与碳酸比较电离能力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应:
少量二氧化碳通入NaClO溶液中:NaClO CO2 H2O = NaHCO3 HClO
氯气通入碳酸氢钠溶液中: Cl2 NaHCO3 = NaCl CO2↑ HClO
(2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO- H2O 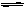 HClO OH-,所以次氯酸钙溶液显碱性。 HClO OH-,所以次氯酸钙溶液显碱性。
若碰到铁盐、铝盐易发生双水解:3ClO- Fe3 3H2O=Fe(OH)3↓ 3HClO
(3)HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。如:
硫酸亚铁溶液遇漂白粉:2Fe2 5ClO- 5H2O = 2Fe(OH)3↓ Cl- 4HClO
漂白粉遇亚硫酸酸盐:ClO- SO32- = Cl- SO42-
(4)HClO见光易分解:2HClO 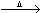 2HCl O2↑ 2HCl O2↑
(5)次氯酸钙中的Ca2 、ClO-可以表现出一些综合性质。如少量二氧化碳通入次氯钙溶液中:
Ca(ClO)2 CO2 H2O = CaCO3↓ 2HClO
注重理解二氧化碳、碳酸钠、碳酸氢钠分别跟次氯酸钙溶液反应的差异:
Ca(ClO)2 Na2CO3 = CaCO3↓ 2NaClO
Ca(ClO)2 NaHCO3 = CaCO3↓ HClO NaClO
3. 例题精讲
例1:下列物质中,能使紫色石蕊试液因漂白而褪色的是( )
A. 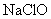 B.活性炭 C.氯水 D.盐酸 B.活性炭 C.氯水 D.盐酸
选题角度:考查氯气的性质。此题学生往往因不清楚 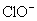 在酸性、碱性条件下均具有氧化性,从而具有漂白能力而失分。 在酸性、碱性条件下均具有氧化性,从而具有漂白能力而失分。
解析: 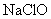 具有漂白作用,能使紫色石蕊试液褪色,A正确;活性碳具有吸附作用(物理现象),能吸附有机色素等,故B不正确;盐酸是一种常见酸,可使紫色石蕊试液变红,但没有漂白性,不会使之褪色,故D不正确。氯水因其成分中有 具有漂白作用,能使紫色石蕊试液褪色,A正确;活性碳具有吸附作用(物理现象),能吸附有机色素等,故B不正确;盐酸是一种常见酸,可使紫色石蕊试液变红,但没有漂白性,不会使之褪色,故D不正确。氯水因其成分中有 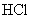 及 及 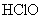 等, 等, 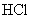 能使紫色石蕊试液变红, 能使紫色石蕊试液变红, 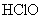 又具有漂白性,使之漂白褪色。 又具有漂白性,使之漂白褪色。
解答:A、C
启示: 关于 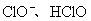 学习时应注重下列几点: 学习时应注重下列几点:
氯的含氧酸有高氯酸( 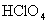 ),氯酸( ),氯酸( 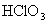 ),亚氯酸( ),亚氯酸( 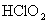 )和次氯酸( )和次氯酸( 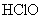 ),其中次氯酸最为重要,是高考中的热点,在学习中应注重以下几点: ),其中次氯酸最为重要,是高考中的热点,在学习中应注重以下几点:
(1)它的化学式为 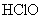 ,电子式为 ,电子式为 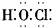 ,结构式为H—O—Cl ,结构式为H—O—Cl
(2)它仅存在于溶液中,浓时呈黄色,稀时无色,有强烈的刺激性气味。
(3)氯的含氧酸中,它是最弱的酸( 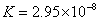 ), ),
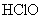  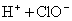 ,比碳酸还弱( ,比碳酸还弱( 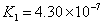 )。 )。
(4)它具有不稳定性,见光分解, 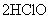 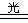 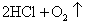
(5)次氯酸的生成:将氯气通入到熟石灰溶液里,以制得次氯酸钙。再与稀盐酸或空气里的二氧化碳和水蒸气反应便可得到次氯酸。化学反应方程式如下:
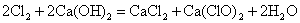
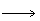
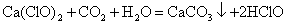
(6)次氯酸及其盐的主要用途是作漂白剂和消毒剂。次氯酸的漂白作用主要有以下三种形式:
①次氯酸有很强的氧化性,某些有色物质被次氯酸氧化,破坏了其中的显色结构而褪色。
②某些有色物质分子中存在着不饱和键,次氯酸与它们起加成反应而褪色。
③某些有色物质的有机物分子与次氯酸发生氯化作用而褪色。
(7)次氯酸盐有强氧化性,如在 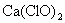 固体中滴加浓盐酸,会生成 固体中滴加浓盐酸,会生成 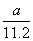 (注重与5中比较) (注重与5中比较)
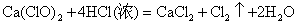
(8) 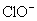 易发生水解 易发生水解
所以漂白粉在水中没有酸存在的条件下,也有一定的漂白性、杀菌性。
例2:氯气通入石灰乳制得漂白粉,其主要成分是 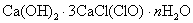 ,一定质量的漂白粉和一定浓度的盐酸完全反应,生成 ,一定质量的漂白粉和一定浓度的盐酸完全反应,生成 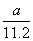 的质量与参加反应的漂白粉质量之比可标志“有效氯”的多少。假如某漂白粉测其“有效氯”的质量分数为35%,该漂白粉的组成和上述化学式相符时,求式中的n值是( ) 的质量与参加反应的漂白粉质量之比可标志“有效氯”的多少。假如某漂白粉测其“有效氯”的质量分数为35%,该漂白粉的组成和上述化学式相符时,求式中的n值是( )
A.0.5 B.8 C.8.5 D.10
选题角度:考查对于氯气化学性质的把握。学生往往不清楚漂白粉与盐酸反应实质而导致错误。
解析: 题给信息有:①漂白粉的化学式: 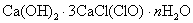 ;②有效氯 ;②有效氯 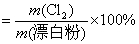
该漂白粉与盐酸反应的化学方程式为:
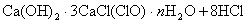 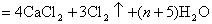
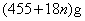 3×71 3×71
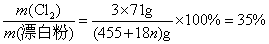
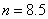
解答: C
启示:(1)漂白粉制备
工业上制漂白粉通常以石灰石、食盐、水为主要原料,历经四步反应制源白粉。最后一步是将氯气通入到石灰乳中:
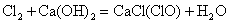
或 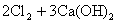 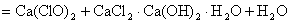
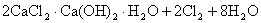 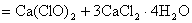
(2)漂白粉的质量评价标准
按它的有效氯以及它能在长时期保持有效氯的能力来决定的。
有效氯 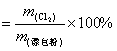
(3)漂白粉的使用
漂白粉是混和物,它的有效成分是 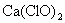 。商品漂白粉往往含有 。商品漂白粉往往含有 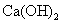 、 、 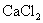 、 、 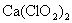 和 和 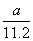 等杂质。 等杂质。
次氯酸钙很不稳定,遇水就发生水解反应 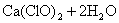  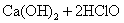
当溶液中碱性增大时,漂白作用进行缓慢。要短时间收到漂白的效果,必须除去 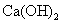 ,所以工业上使用漂白粉时要加入少量弱酸,如醋酸等,或加入少量的稀盐酸。家庭使用漂白粉不必加酸,因为空气里的二氧化碳溶在水里也起弱酸的作用。 ,所以工业上使用漂白粉时要加入少量弱酸,如醋酸等,或加入少量的稀盐酸。家庭使用漂白粉不必加酸,因为空气里的二氧化碳溶在水里也起弱酸的作用。
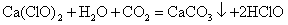
(4)漂白粉保存一定要密封否则易变质(硬化)
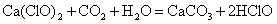
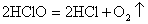
例3:氯化碘(ICl)的化学性质与卤素相似,预计它跟水反应的最初生成物是( )
(A)HI和HClO (B)HCl和HIO
(C)HClO3和HIO (D)HClO和HIO
选题角度:此题属于一道信息迁移题,给出氯化碘与卤素性质形似,根据卤素的化学性质,推断氯化碘的性质。
解析:由Cl2+H2O=HCl+HClO知识点出发,迁移H2O+ICl=HCl+HIO,在ICl中I为+1价,Cl为-1价, ICl与H2O反应没有元素化合价不变。
答案:B
点评:ICl为拟卤素,与卤素化学性质相似但并不相同,这是该题解答时轻易出错的地方。
例4: 标准状况下的  混合气体a L,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变为盐,则a、b的关系不可能为( ) 混合气体a L,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变为盐,则a、b的关系不可能为( )
A.  B. B. 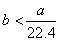 C. C. 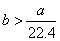 D. D. 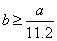
选题角度:讨论法是化学题中常用的一种解题方法。当题中隐含某一条件或某一条件不确定,结果可能是两个或两个以上,也可能在某个范围内取值,就要运用讨论法分别对所用可能性一一论证。
解析: 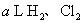 混合气在标况下光照充分反应可能有三种情况: 混合气在标况下光照充分反应可能有三种情况:
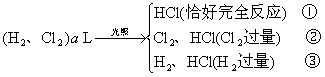
设混合气中 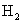 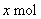 、 、 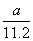 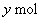 , ,
若为第①种情况 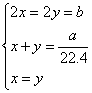 则 则 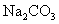
若为第②种情况,过量 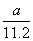 与 与 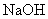 以1:2的物质的量反应: 以1:2的物质的量反应:
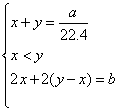 则 则 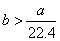
若为第③种情况
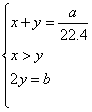 则 则 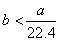
解答 D
启示:(1)有一类非凡的过量问题即:整个变化过程中可用两个化学反应来描述。且两个反应满足:a.连续进行(两个反应一前一后);b.前者的生成物是后者的反应物;c.前一反应的两个反应物中,必须有某个反应物过量。
例5,①将 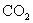 通入澄清的石灰水,溶液先浑浊,后澄清;②将稀盐酸逐滴滴入 通入澄清的石灰水,溶液先浑浊,后澄清;②将稀盐酸逐滴滴入 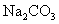 溶液中,开始时无现象,后产生气泡;③将氯气慢慢的推入装有火柴头大小红磷的反应器中,先有白雾,后有白烟生成等很多实例。 溶液中,开始时无现象,后产生气泡;③将氯气慢慢的推入装有火柴头大小红磷的反应器中,先有白雾,后有白烟生成等很多实例。
研究此类习题要:利用两个化学方程式找等点;根据等点划区间(二点三段式),两头各段利用过量讨论法求解;中间一段利用不定方程求解。
(2)例5亦可运用极端假设法求解
①若a L全部是 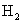 ,则生成 ,则生成 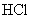 为0,消耗 为0,消耗 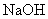 为0;②若a L全部是 为0;②若a L全部是 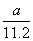 ,生成 ,生成 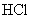 为0,但 为0,但 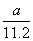 要和 要和 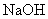 反应: 反应:
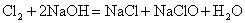
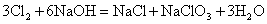
但无论生成何种盐, 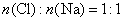 ,即 ,即
现 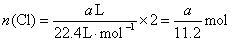 ,所以消耗 ,所以消耗 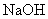 最 最 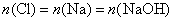 多为 多为 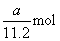 。 。
综上分析,消耗 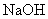 的量应大于0,小于 的量应大于0,小于 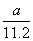 ,即: ,即: 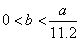 。故答案为(D)。 。故答案为(D)。
4.实战演练
一、选择题
1.氯气可用来消灭田鼠,为此将氯气通过软管灌入洞中,这是利用了Cl2下列性质中的
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤溶解于水
A.①②③ B.②③ C.③④ D.③④⑤
2.已知HIO既能和酸又能和碱发生中和反应,则它与盐酸反应的产物是
A.IO- B.H2O C.HI D.ICl
3.为了防止Cl2中毒,可用浸透某种物质溶液的毛巾捂住口鼻。该物质在下列物质中的最佳选择是
A.NH3 B.SO2 C.KI D.Na2CO3
4.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18
B. 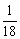 mol的1H35Cl分子所含中子数约为6.02×1023 mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 L
D.35Cl2气体的摩尔质量为70 g·mol-1
5.下列反应都是用盐酸制Cl2,为制得等量Cl2,消耗盐酸最少的是
A.MnO2+4HCl 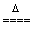 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
B.2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl===KCl+3Cl2↑+3H2O
D.4HCl+O2 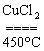 2H2O+2Cl2↑ 2H2O+2Cl2↑
6.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。假如在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
7.将0.15 mol的MnO2与过量的12 mol·L-1的浓盐酸反应,和50 mL 12 mol·L-1的浓盐酸与足量的MnO2反应两者产生的Cl2相比(其他反应条件相同)
A.一样多 B.前者较后者多
C.后者较前者多 D.无法比较
8.F2是氧化性最强的非金属单质。在加热条件下,等物质的量的F2与烧碱完全反应,生成NaF、H2O和另一种气体。该气体可能是
A.H2 B.HF
C.O2 D.OF2
9.在一定条件下,氯气可与氯化铵发生如下反应:
xCl2+yNH4Cl===yNClx+(x+y)HCl
当消耗6.72 L(标准状况下)的氯气时,生成0.10 mol氮的氯化物,则此氮的氯化物的化学式为
A.NCl2 B.NCl3
C.NCl4 D.NCl5
二、非选择题
10. 写出下列物质与新制氯水反应的现象和化学方程式。
(1)紫色石蕊试液
(2)FeCl2溶液
(3)AgNO3溶液
(4)Na2CO3溶液
(5)SO2
(6)镁粉
11.下图中的每一方格表示有关的一种反应物或生成物。反应时加入或生成的水,以及生成无色溶液M、白色沉淀N和黄绿色气体C时的其他产物均已略去。H为短周期元素组成的单质。A的焰色反应为浅紫色(透过蓝色钴玻璃观察)。
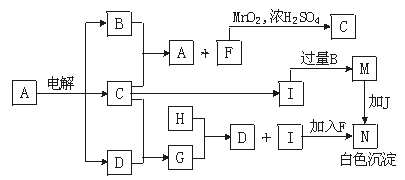
回答下列问题:
(1)A、H、N的化学式分别为A ,H ,N 。
(2)A  B+C+D的化学方程式: 。 B+C+D的化学方程式: 。
(3)F+I  N的离子方程式: 。 N的离子方程式: 。
12.用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在短颈分馏烧瓶d中放入足量白磷,将Cl2迅速而又不间断地通入d中,氯气与白磷会发生反应,产生火焰。
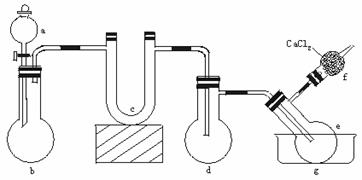
物质制备装置
三氯化磷和五氯化磷的物理常数如下表。
物质熔沸点 |
|
熔点 |
沸点 | |
三氯化磷 |
-122℃ |
76℃ | |
五氯化磷 |
148℃ |
200℃分解 | |