|
考点解析复习专题辅导25.硝酸
1.复习重点
1、记住硝酸的物理性质。
2、把握并能灵活运用硝酸的化学性质。
3、把握实验室制取硝酸的方法。
4、把握工业上氨催化氧化制硝酸的反应原理,常识性了解其主要生成过程。了解NO
和NO2对环境的污染及其防治方法。
2.难点聚焦
一、 物理性质
纯净硝酸是无色、易挥发,有刺激性气味的液体,密度比水大。因为它的晶体为分子
晶体,所以它的熔沸点较低。因为硝酸分子为强极性分子,所以它能以任意比溶于水。常用浓硝酸的质量分数大约是69%。98%以上的浓硝酸叫“发烟硝酸”。浓硝酸为挥发性酸,打开瓶盖露置于空气中,瓶口上方观察到白雾。
二、 化学性质
硝酸溶于水发生完全电离:HNO3=H NO3-,常用浓硝酸中,硝酸也是以离子形成存
在于水溶液中,因此硝酸具有酸的通性。硝酸是一种强酸,除具有酸的通性外还有它本身的特性。
1、硝酸的不稳定性
 4e 4e
 4HNO3 △ 2H2O 4NO2↑ O2↑ 4HNO3 △ 2H2O 4NO2↑ O2↑
或光照
硝酸的浓度越大越易分解,温度越高分解越快,光越强分解越快。为了防止硝酸的分
解,必须把它盛在棕色瓶里密封贮放在黑暗而且温度低的地方。常用浓硝酸略带黄色,是因为少部分硝酸分解而产生的NO2气体溶解在硝酸中的缘故。
假如将浓硝酸加热分解产生的气体收集起来再溶于水时,该混合气可被水完全吸收,无残留气体。这是因为收集到的气体中 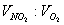 =4:1溶于水时,发生反应:4NO2 O2 2H2O=4HNO3,恰好均被完全吸收。 =4:1溶于水时,发生反应:4NO2 O2 2H2O=4HNO3,恰好均被完全吸收。
2、硝酸的氧化性
硝酸是一种很强的氧化剂,不论稀硝酸还是浓硝酸都有氧化性。硝酸越浓氧化性越强。
同浓度的硝酸温度越高氧化性越强。硝酸能氧化除Pt、Au之外的绝大多数金属,还能氧化许多非金属(如碳、硫、磷),及具有还原性的物质(如H2S、Na2SO3、SO2、HBr、HI、Fe2 、Sn2 ,松节油、锯未等)。如:
铜、汞、银等不活泼金属与浓硝酸剧烈反应,一般认为生成硝酸盐和二氧化氮而与稀硝酸反应通常需加热,产生金属硝酸盐和一氧化氮,在反应中硝酸均既表现氧化性又表现酸性。
Cu 4HNO3(浓)= Cu (NO3)2 2NO2↑ 2H2O ……………………①
 3Cu 8HNO3(稀) △ 3Cu (NO3)2 2NO↑ 4H2O …………………② 3Cu 8HNO3(稀) △ 3Cu (NO3)2 2NO↑ 4H2O …………………②
上述两反应均可用离子方程式表示为:
Cu 4H 2NO3-=Cu2 2NO2↑ 2H2O
3 Cu 4H 2NO3-=2Cu3 2NO↑ 4H2O
值得注重的是切不可以还原产物的价态来判定硝酸氧化性的强弱,必须肯定浓硝酸氧化性强于稀硝酸氧化性。同时必须切实知道反应中作为氧化剂的硝酸的物质的量等于产生气体(氮的氧化物)的物质的量,即使产生NO2和NO的混合气体亦是如此。
反应①可用作实验室制取NO2气体,用平底烧瓶分液漏斗、双孔塞组合实验装置,由于反应剧烈,可控制滴加浓硝酸的速率控制产生NO2的速率,只能用向上排空气法收集NO2气体,多余的NO2气体可用碱液吸收。该制取应在通风橱中进行。反应②可作为实验室制取NO的反应,装置选择固 液 △ 气的装置,只能用排水法收集。
铝、铁遇冷的浓硝酸产生钝化现象,即浓硝酸将它们表面氧化成一层薄而致密的氧化物薄膜、阻止了进一步反应的缘故。
铁在过量的浓硝酸中加热发生反应为:
    Fe 6HNO3(浓) △ Fe (NO3)3 3NO2↑ 3H2O Fe 6HNO3(浓) △ Fe (NO3)3 3NO2↑ 3H2O
过量的铁在稀硝酸中发生反应为:
3Fe 8HNO3(稀) △ 3Fe (NO3)2 2NO↑ 4H2O
活泼金属跟稀硝酸反应,由于金属的强还原性,还原产物较为复杂。例如:4Mg 10HNO3(稀)=4Mg (NO3)2 NH4NO3 3H2O。
王水(浓硝酸和浓盐酸体积比)能使Pt、Au溶解。
碳、硫、磷等非金属单质在热而浓的硝酸中剧烈反应:
C 4HNO3(浓) △ CO2↑ 4NO2↑ 2H2O
 S 6HNO3(浓) △ H2SO4 6 NO2↑ 4H2O S 6HNO3(浓) △ H2SO4 6 NO2↑ 4H2O
 P 5HNO3(浓) △ H3PO4 5 NO2↑ H2O P 5HNO3(浓) △ H3PO4 5 NO2↑ H2O
 P4 20HNO3(浓) △ 4H3PO4 20 NO2↑ 4H2O P4 20HNO3(浓) △ 4H3PO4 20 NO2↑ 4H2O
某些还原性的化合物能被硝酸氧化:
3Na2SO3 2HNO3(稀)=3Na2SO4 2NO↑ H2O
3H2S 2HNO3=3S 2NO 4H2O
 2NaBr 4HNO3(稀)△ 2NaNO3 2NO2↑ Br2↑ H2O 2NaBr 4HNO3(稀)△ 2NaNO3 2NO2↑ Br2↑ H2O
6KI 8HNO3(稀)=6KNO3 I2 2NO↑ 4H2O
三、 硝酸的制法
1、硝酸的实验室制法
硝酸有挥发性,所以在实验室里可以把硝酸盐跟浓硫酸共同加热来制取。反应为:
 NaNO3 H2SO4(浓) △ NaHSO4 HNO3↑ NaNO3 H2SO4(浓) △ NaHSO4 HNO3↑
装置图:
注重:加热时最好微热。因为HNO3受热易分解。制得的硝酸常略显黄色,是因为溶有少量NO2的缘故。
2、硝酸的工业制法(氨的催化氧化法)
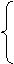 氨氧化生成一氧化氮 氨氧化生成一氧化氮
两个阶段
一氧化氮氧化生成二氧化氮,二氮化氮被水吸收而生成硝酸
反应方程式:
 4NH3(气) 5O2(气) 催化剂 4NO(气) 6H2O(气) 907KJ 4NH3(气) 5O2(气) 催化剂 4NO(气) 6H2O(气) 907KJ
2NO(气) O2(气)= 2NO2(气) 113kJ
3NO2(气) H2O(液)= 2HNO3(液) NO(气) 136KJ
设备:氧化炉、吸收塔
吸收剂:水或稀硝酸
浓缩剂:硝酸镁或浓硫酸
尾气吸收剂:氢氧化钠溶液。(NO NO2 NaOH=2NaNO2 H2O)
注重点:在吸收反应进行过程中补充一些空气,使吸收生成的NO再氧化为NO2,NO2
溶于水又生成HNO3和NO,经过多次的氧化和吸收,二氧化氮可以完全地被水吸收,能够尽可能多地转化为硝酸。因此起始物和反应终产物物质的量间关系为:1molNH3 转化 1molHNO3。
3.例题精讲
例1、1.92gCu片与定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则反应中消耗HNO3_______mol被还原的HNO3________mol,转移电子________mol。
解析:ne=nCu×2= 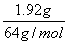 ×2=0.06mol ×2=0.06mol
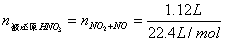 =0.05mol =0.05mol
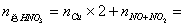 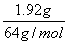 ×2 0.05mol=0.11mol ×2 0.05mol=0.11mol
答案:0.11、0.05、0.06。
例2、现有下列三个方案用于制取硝酸铜,要求:①不污染环境 ②原料利用率高。请对下列三个方案加以评价。
方案一:用铜屑与浓硝酸作用。
方案二:用铜屑与中等浓度的硝酸作用,生成的NO和NO2气体用NaOH吸收。
方案三:先将铜屑在空气中灼热,使其完全氧化,再用硝酸溶解上述产物。
   解析:方案一的制备反应为:Cu 4HNO3(浓) △ Cu (NO3)2 2NO2↑ 2H2O。制备1mol Cu (NO3)2需4mol HNO3,反应放出的NO2未处理,对环境有污染。方案二的制备除含方案一反应外还有反应:3Cu 8HNO3=3Cu (NO3)2 2NO↑ 4H2O,制备1mol Cu (NO3)2需 解析:方案一的制备反应为:Cu 4HNO3(浓) △ Cu (NO3)2 2NO2↑ 2H2O。制备1mol Cu (NO3)2需4mol HNO3,反应放出的NO2未处理,对环境有污染。方案二的制备除含方案一反应外还有反应:3Cu 8HNO3=3Cu (NO3)2 2NO↑ 4H2O,制备1mol Cu (NO3)2需 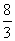 ~4mol HNO3。反应放出的NO2和NO可基本被吸收,对环境污染较小。方案三的制备反应也有两个:2Cu O2 △ 2CuO, CuO 2HNO3=Cu (NO3)2 H2O,制备1mol Cu (NO3)2需2molHNO3,对环境的污染也较小。 ~4mol HNO3。反应放出的NO2和NO可基本被吸收,对环境污染较小。方案三的制备反应也有两个:2Cu O2 △ 2CuO, CuO 2HNO3=Cu (NO3)2 H2O,制备1mol Cu (NO3)2需2molHNO3,对环境的污染也较小。
答案:由上综合分析可知,方案三最合理。
例3、在锌跟稀硝酸反应时,若参加反应的锌与消耗的硝酸的物质的量之比为1:2.5时,则被还原的HNO3和未被还原的HNO3的物质的量之比为
A、2:5 B、1:4 C、1:5 D、1:9
解析:Zn与HNO3的物质的量比为1:2.5即4:10。
则:4Zn 10HNO3=4Zn (NO3)2 N2O↑ 5H2O ……………………①
4Zn 10HNO3=4Zn (NO3)2 NH4NO3↑ 3H2O ……………………②
按反应① 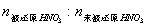 =1:4,按反应② =1:4,按反应②
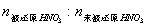 =1:9 =1:9
答案:BD。
例4、工业上由氮气制得氨气,氨再经催化氧化最终制得硝酸,如用去标准状况下560m3空气中的氮气(按N2占空气体积的4/5计算),则理论上可制得12mol/ L的硝酸多少立方米(设反应过程中氮损失16%)?
解析:生成硝酸的体积为V
N2 2NH3 2HNO3
1 2
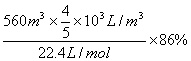 V×103L/m3×12mol/L V×103L/m3×12mol/L
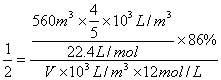
V=2.8m3
答:理论上可制得2.8m312mol/L的硝酸。
例5.同温同压下,两个等体积的干燥圆底烧瓶中分别布满:①NH3,②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为 ( )
A.①>② B.①<② C.①=② D.不能确定
解析:可先设烧瓶容积为1L,则NH3瓶中水布满整个烧瓶,NO2瓶中水布满烧瓶的2/3,如在标准状况下测定,则氨水的物质的量浓度为c=  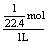 ,HNO3溶液物质的量浓度为c= ,HNO3溶液物质的量浓度为c= 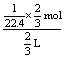 。参考答案:C 。参考答案:C
例6.从某些性质看,NH3与H2O相当,NH4 与H3O ,NH2—与O2—都有相当关系,下列有关方程式不正确的是 ( )
A. NH4Cl KNH2=KCl 2NH3↑
B. M 2NH3=M(NH2)2 H2↑(M为二价活泼金属)
C. 2NH4Cl MNH=MCl2 NH3
D. 2NH4Cl MO=M(NH2)2 2HCl H2O
解析:A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中MNH可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则有反应2NH4Cl MO=MCl2 NH3↑ H2O
4.实战演练
一、 选择题:
1、下列有关硝酸化学性质的叙述中正确的是( )
A、浓、稀硝酸都能使蓝色石蕊试剂变红
B、硝酸(过量)能与Na2SO3反应,但不生成SO2
C、稀硝酸可与Na2S反应制得H2S
D、在碘化钾淀粉溶液中滴加稀硝酸溶液呈蓝色
2、污染环境的有害气体中,主要由于跟血红蛋白作用而引起中毒的有毒气体是( )
A、SO2 B、CO2 C、NO D、CO
3、某二价金属跟硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则反应中唯
一的还原产物可能是( )
A、NH3 B、N2O C、NO D、NO2
4、可不用棕色瓶存放,但必须用玻璃塞试剂瓶存放的药品是( )
A、氯水 B、硝酸银溶液 C、液溴 D、烧碱
5、Cu粉放A稀H2SO4中,加热后也无现象,当加入一种盐后,Cu粉质量减少,而
溶液变蓝,同时有气体生成,此盐是( )
A、氯化物 B、硫酸盐
C、硝酸盐 D、磷酸盐
6、下列酸的酸酐难以由单质间直接化合生成的有( )
A、H2CO3 B、HNO3 C、H2SO3 D、H2SO4
7、下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
A、Fe2O3 HNO3 B、Al (OH)3 HNO3
C、C HNO3(浓) D、Cu HNO3
8、当三份Cu粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应后,收集到的气体在
相同状况下体积相等时,三份Cu粉的质量比为(不考虑NO2转化成N2O4和反应生成气体的溶解)
A、3:1:2 B、3:2:2 C、1:1:2 D、2:6:3
9、下列关于浓硝酸和浓硫酸的叙述,正确的是( )
A、常温下都能用铝容器贮存
B、常温下都能与铜较快反应
C、露置在空气中,容器内酸液的质量都减少
 D、露置在空气中,容器内酸液的浓度均降低 D、露置在空气中,容器内酸液的浓度均降低
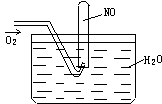
10、按右图进行实验,试管内装有12mLNO,然后间歇而缓慢
地通入8mLO2。下面有关实验最终状态的描述正确的是( )
A、试管内气体呈棕红色 B、试管内气体为无色是NO
C、试管内气体为无色是O2 D、试管内液面高度上升
二、 填空:
11、工业上制硝酸时,为使50%的硝酸转变为96%以上的硝酸,可采取的描施是
_______________________________。
12、检验硝酸钠晶体中硝酸根离子的方法是_______________________________。
三、 推断
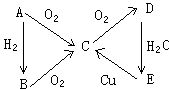 13、A、B、C、D、E五种物质能按图示变化(反应条件略): 13、A、B、C、D、E五种物质能按图示变化(反应条件略):
①若A在通常状况下是固体,则A、B、C、D、E的化学式分别
为:A____, B____, C____, D____, E_____。
②若A在通常状况下是气体,则A、B、C、D、E的化学式分别是:A____, B____, C____, D____, E_____。
14、下图中的每方格表示有关的一种反应物或生成物,其中A和C 为无色气体。
  
 
 盐酸 A Na O D 木炭 盐酸 A Na O D 木炭
    ( = 1 \* ROMAN I) △ ( = 1 \* ROMAN I) △
 
M 加热 B F G


  NaOH C D E Cu NaOH C D E Cu
△ 催化剂 △ ( = 2 \* ROMAN II)
填写下列空白:
①物质M可以是_____________,C是_________________,F是________________。
②反应( = 1 \* ROMAN I)的化学方程是___________________________。
③反应( = 2 \* ROMAN II)的离子方程是___________________________。
一、选择题:
1、BD 2、CD 3、B 4、C 5、C 6、BD 7、D 8、A 9、AD
10、BD
二、填空:
11、加入硝酸镁晶体或浓硫酸后进行蒸馏。
12、取少许晶体于洁净试管中加入适量浓硫酸后,插入一根螺旋状粗铜丝,如有红棕色
气体迅速产生,即证实晶体中有硝酸根离子。
三、推断
13、①S,H2S,SO2,SO3,H2SO4
②N2,NH3,NO,NO2,HNO3
14、①NH4HCO3或(NH4)2CO3,NH3,NO2
②2CO2 2Na2O2=2Na2CO3 O2
③3Cu 2NO3- 8H =3Cu2 2NO↑ 4H2O
|